
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X 射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:
X+4HNO3=PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是___________ ,PbO2不是碱性氧化物,判断的依据 _________。
②X的化学式是___________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式____________。
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a为分解40%的残留固体。若a点固体组成表示为PbOx,则x= _________,将化学式改写成mPbO·nPbO2_______,(m、n取正整数)。已知+4价Pb的氧化性强于Cl2则该化合物和浓盐酸反应的化学反应方程式___________。
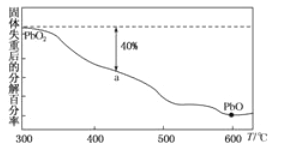
【答案】 +4 PbO2 不能与硝酸反应生成盐和水 Pb3O4 PbO+ClO-=PbO2+Cl- 1.6 2PbO·3PbO2 2PbO·3PbO2+16HCl(浓)![]() 5PbCl2+3Cl2+8H2O
5PbCl2+3Cl2+8H2O
【解析】(1)试题分析:(1)①根据元素化合价代数和等于0计算铅元素的化合价;碱性氧化物能与酸反应生成盐和水;②根据元素守恒判断X的化学式;(2)根据题意 PbO被次氯酸钠氧化为PbO2,次氯酸钠被还原为氯化钠;根据PbO2完全分解生成PbO,失去1个O原子分析;根据元素守恒计算m、n的比;已知+4价Pb的氧化性强于Cl2,该化合物能把浓盐酸氧化成氯气。
解析:(1)①根据元素化合价代数和等于0, PbO2中铅元素的化合价是+4;碱性氧化物能与酸反应生成盐和水,红丹与过量浓硝酸反应生成PbO2 ,可知PbO2不能与硝酸反应生成盐和水,所以PbO2不是碱性氧化物;②根据元素守恒,判断X的化学式是Pb3O4;(2)根据题意 PbO被次氯酸钠氧化为PbO2,次氯酸钠被还原为氯化钠,反应的离子方程式是PbO+ClO-=PbO2+Cl-; (3)PbO2完全分解生成PbO,失去1个O原子,a点分解率为40%,所以失去0.4个O原子,a点的化学式是PbO1.6,x=1.6;根据元素守恒,则O原子与Pb原子的比值为1:1.6,则![]() , m:n=2:3,化学式是2PbO·3PbO2;已知+4价Pb的氧化性强于Cl2,所以该化合物能把浓盐酸氧化成氯气,方程式是2PbO·3PbO2+16HCl(浓)
, m:n=2:3,化学式是2PbO·3PbO2;已知+4价Pb的氧化性强于Cl2,所以该化合物能把浓盐酸氧化成氯气,方程式是2PbO·3PbO2+16HCl(浓)![]() 5PbCl2+3Cl2+8H2O。
5PbCl2+3Cl2+8H2O。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,在强碱性溶液中能共存的是( )
A. Na+、Cl- 、Mg2+、NO3- B. Na+、Ba2+、Cl-、AlO2-
C. NH4+、K+、Cl-、NO3- D. K+、Mg2+、ClO-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述正确的是( )
A. 植物油不能使溴水褪色
B. 淀粉水解的最终产物是葡萄糖
C. 葡萄糖能发生氧化反应和水解反应
D. 蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明的中性溶液中:Fe3+、Ba2+、NO3-、Cl-
B.使甲基橙变黄色的溶液中: Na+、AlO2-、SO42-、Cl-
C.c(OH–)=1×10-13mol/L的溶液中: NH4+、Ca2+、Cl-、NO3-
D.能使红色石蕊试纸变为蓝色的溶液:Na+、Cl、S2、ClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 纤维素属于多糖,在人体内水解转化为葡萄糖,也可为人类提供能量
B. 糖尿病患者吃糖量必须限制,但淀粉类食物不必进行限制
C. 同质量的脂肪在体内氧化时放出的能量比糖类物质和蛋白质高得多,是提供能量的主要物质
D. 葡萄糖在人体内不可以转化为脂肪,不使人发胖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2是一种常用的自来水消毒剂,高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出.
Ⅰ:下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).

(1)装置B中饱和食盐水的作用是____________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象__________________________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入__________。
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II:制备高铁酸钾的方法有干法和湿法。
(3)干法制备高铁酸钾的主要反应为:
2FeSO4+ 6Na2O2= 2Na2FeO4+ 2Na2O + 2Na2SO4+ O2↑
①该反应中的还原剂是_______,每生成lmolNa2FeO4转移____个电子。
②简要说明K2FeO4作为水处理剂时所起的作用________________________________,
(4)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用。有机物M是中药狼把草的成分之一,其结构如图所示。下列叙述不正确的是( )

A. M是芳香族化合物,它的分子式为C9H5O4Cl
B. 1 mol M最多能与含2 mol Br2的溴水发生反应
C. 1 mol M分别与足量的NaOH溶液、Na2CO3溶液反应,消耗两种物质的物质的量分别为4 mol、2mol
D. 在一定条件下能发生取代、加成、水解、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在aL Al2(SO4)3和(NH4)2SO4的混合溶液中加入bmol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmol NH3,则原溶液中的Al3+离子浓度(mol·L-1)为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对金属腐蚀及防护的表述正确的是
A.金属腐蚀的本质:金属失电子发生还原反应
B.牺牲阳极的阴极保护法:被保护的金属应做负极
C.外加电流阴极保护法:被保护的金属应与电源正极相连
D.生铁投入NH4Cl溶液中:主要发生析氢腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com