
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)如图装置A烧瓶内试剂可选用______(填序号);①浓硫酸 ②碱石灰 ③五氧化二磷 ④烧碱固体;实验室制取氨气常用另外一种固体和固体加热的方法,写出该方法的化学方程式______________________。
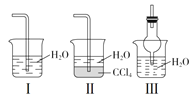
(2)若探究氨气的溶解性,上图需在K2的导管末端连接下图装置中的_________装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________________。
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置,D中氨气与氯气反应产生白烟,该反应的化学方程式为__________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为__________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为_____g(小数点后保留两位有效数字)。
【答案】②④ 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O II或III 用热毛巾将烧瓶捂热 8NH3+3Cl2=6NH4Cl+ N2 2NH3+3O2
CaCl2+2NH3↑+H2O II或III 用热毛巾将烧瓶捂热 8NH3+3Cl2=6NH4Cl+ N2 2NH3+3O2![]() 2HNO2+2H2O 2.35
2HNO2+2H2O 2.35
【解析】
(1)氨水易挥发,升高温度能促进氨水分解生成氨气,为促进氨水分解,则烧瓶中加入的物质遇氨水后能放出大量热,且和氨水不反应;实验室可用氢氧化钙与氯化铵加热制备氨气;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置;利用压强差将烧杯中的水排到烧瓶中;
(3)依据氧化还原反应的规律根据反应物和生成物再结合原子守恒定律写出反应方程式;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水;结合元素的化合价变化进行计算。
氨气为碱性气体,结合上述分析可知,
①浓硫酸和氨水反应,①项错误;
②碱石灰遇水放出大量热,能使氨水温度升高,且和氨水不反应,②项符合题意;
③五氧化二磷和氨水反应,③项错误;
④烧碱固体溶解过程中放出大量热,能使氨水温度升高,且和氨水不反应,④项符合题意,
综上所述,②④正确;
实验室还可用固体氯化铵与氢氧化钙在加热条件下制备氨气,其化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O,
CaCl2+2NH3↑+H2O,
故答案为:②④;2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+H2O;
CaCl2+2NH3↑+H2O;
(2)氨气极易溶于水,为防止倒吸,吸收氨气的装置中应该有缓冲装置,Ⅱ、Ⅲ装置中都有缓冲装置,Ⅰ没有缓冲装置能产生倒吸,故选Ⅱ或Ⅲ;利用压强差将烧杯中的水排到烧瓶中,操作为用热毛巾将烧瓶捂热,烧瓶中的空气进入烧杯中,导致大气压强大于烧瓶中气体压强,从而使烧杯中的水通过导管进入烧瓶中产生喷泉实验,
故答案为:Ⅱ或Ⅲ;用热毛巾将烧瓶捂热;
(3)氨气与氯气反应产生白烟的同时还生成氮气,结合氧化还原反应的规律可知所以其反应方程式为:8NH3+3Cl2=6NH4Cl+ N2,
故答案为:8NH3+3Cl2=6NH4Cl+ N2;
(4)氨能够被氧气氧化生成亚硝酸(HNO2),由质量守恒定律可知还生成水,该反应为2NH3+3O2![]() 2HNO2+2H2O,由反应可知,N的化合价由-3价升高为+3价,故生成1molHNO2时转移1mol×[3-(-3)]=6mol电子,则有0.3mol电子发生转移时,生成亚硝酸
2HNO2+2H2O,由反应可知,N的化合价由-3价升高为+3价,故生成1molHNO2时转移1mol×[3-(-3)]=6mol电子,则有0.3mol电子发生转移时,生成亚硝酸![]() =0.05mol,其质量为0.05mol×47g/mol=2.35g,
=0.05mol,其质量为0.05mol×47g/mol=2.35g,
故答案为:2NH3+3O2![]() 2HNO2+2H2O;2.35。
2HNO2+2H2O;2.35。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
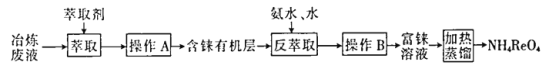
【题目】CCTV在“新闻30分”中介绍:王者归“铼”,我国发现超级铼矿,飞机上天全靠它。铼的稳定硫化物有ReS2,稳定的氧化物有Re2O7。工业上,常从冶炼铜的废液中提取铼,其简易工艺流程如下(部分副产物省略,铼在废液中以ReO4-形式存在):
回答下列问题:
(1)NH4ReO4(高铼酸铵)中铼元素化合价为_________________。
(2)操作A的名称是_____________。
“萃取”中萃取剂应具有的性质:______(填代号)。
①萃取剂难溶于水 ②萃取剂的密度大于水
③ReO4-在萃取剂中的溶解度大于在水中的溶解度 ④萃取剂不和ReO4-发生反应
(3)在“反萃取”中,加入氨水、水的目的是_________________。
(4)在高温下高铼酸铵分解生成Re2O7,用氢气还原Re2O7,制备高纯度铼粉。
①写出高铼酸铵分解生成Re2O7的化学方程式_____________________。
②工业上,利用氢气还原Re2O7制备铼,根据生成铼的量计算氢气量,实际消耗H2量大于理论计算量,其原因是_____________________。
(5)工业上,高温灼烧含ReS2的矿粉,可以制备R2O7。以含ReS2的矿石原料生产48.4tRe2O7,理论上转移__________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物是由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积):下列说法中不正确的是( )

A.该固体中一定没有FeCl2,可能含有AlCl3
B.该固体中含有2.70 g Al
C.该固体中含有6.60 g (NH4)2SO4
D.该固体中含有4.75 g MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应常常伴随颜色变化,下列反应产物的颜色按红色、红褐色、黑色、蓝色顺序排列的是( )
①金属铁在纯氧中燃烧冷却后
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间后
③NaOH溶液中滴入酚酞
④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于二氧化硅和二氧化碳的说法正确的是( )
A.常温下二氧化硅和二氧化碳都是气体
B.二氧化硅和二氧化碳都不溶于水
C.二氧化硅和二氧化碳在一定条件下都可以是固体
D.二氧化硅和二氧化碳的硬度小、熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,B、 D是中学化学常见金属,D在生活中应用最广泛。

(1)写出物质A与盐酸反应的离子方程式_____。
(2)探究A和B反应后固体的性质:将反应后容器中的残余固体置于烧杯中,加入100mL稀硝酸,固体完全溶解, (假设固体全部溶解后溶液体积不变),反应过程中无气体放出 (活泼金属可把稀HNO3还原为NH4NO3)。向反应后的溶液中缓慢滴加4mol·L-1的NaOH溶液,产生沉淀的物质的量与加入NaOH溶液的体积的关系如图所示:
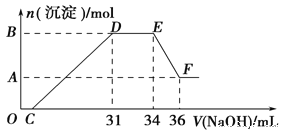
①写出DE段发生反应的离子方程式:_____。
②B与A的差值为_____mol。
③求c(HNO3)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。则下列说法不正确的是
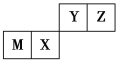
A. M形成的简单离子的半径小于Z的形成的简单离子的半径
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:
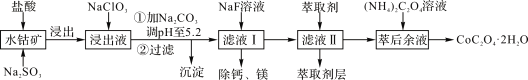
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)浸出过程中加入Na2SO3的主要目的是________。
(2)向浸出液中加入NaClO3的离子反应方程式:_________。
(3)已知:常温下NH3·H2O![]() NH4++OH- Kb=1.8×10-5
NH4++OH- Kb=1.8×10-5
H2C2O4![]() H++HC2O4- Ka1=5.4×10-2
H++HC2O4- Ka1=5.4×10-2
HC2O4-![]() H+C2O42- Ka2=5.4×10-5
H+C2O42- Ka2=5.4×10-5
则该流程中所用(NH4)2C2O4溶液的pH______7(填“>”或“<”或“=”)。
(4)加入(NH4)2C2O4 溶液后析出晶体,再过滤、洗涤,洗涤时可选用的试剂有:________。
A.蒸馏水 B.自来水 C.饱和的(NH4)2C2O4溶液 D.稀盐酸
(5)萃取剂对金属离子的萃取率与pH的关系如右图1,萃取剂的作用是________;其使用的适宜pH范围是________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)CoC2O4·2H2O热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600 ℃以后是在空气中加热。A、B、C均为纯净物;C点所示产物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:![]() 增大
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com