
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。则下列说法不正确的是
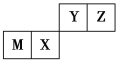
A. M形成的简单离子的半径小于Z的形成的简单离子的半径
B. Y的最高价氧化物对应水化物的酸性比X的弱
C. X的最简单气态氢化物的热稳定性比Z的弱
D. Z位于元素周期表中第二周期第ⅥA族
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较,正确的是
A.沸点:CH3(CH2)2CH3>(CH3)3CH
B.水中溶解性:C2H5Br>C2H5OH
C.密度:水>C2H5Br
D.碳碳键键长:乙炔>苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)如图装置A烧瓶内试剂可选用______(填序号);①浓硫酸 ②碱石灰 ③五氧化二磷 ④烧碱固体;实验室制取氨气常用另外一种固体和固体加热的方法,写出该方法的化学方程式______________________。
(2)若探究氨气的溶解性,上图需在K2的导管末端连接下图装置中的_________装置(填序号),当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是______________________。
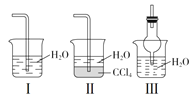
(3)若探究氨气的还原性,需打开K1、K3,K2处导管连接制取纯净、干燥氯气的装置,D中氨气与氯气反应产生白烟,该反应的化学方程式为__________________。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为__________,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为_____g(小数点后保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止金属氧化,宋老师想了很多办法,她发现有些活泼金属在空气中易与氧气反应,表面生成一层致密的氧化膜,可以保护内层金属不被继续氧化的是( )
①铁 ②钠 ③铝 ④镁
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列单质或化合物性质的描述正确的是( )
A. NaHSO4水溶液显中性
B. SiO2与酸、碱均不反应
C. SiO2是酸性氧化物,能与NaOH溶液反应
D. Fe在足量Cl2中燃烧生成FeCl2和FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
PbCl42-(aq)。不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是___________________________________________________________________。
③将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

ⅰ.溶液3应置于_________ (填“阴极室”或“阳极室”)中。
ⅱ.简述滤液2电解后再生为FeCl3的原理______________________________________。
ⅲ.若铅精矿的质量为a g,铅浸出率为b ,当电解池中通过c mol电子时,金属铅全部析出,铅精矿中PbS的质量分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知:SOCl2+H2O![]() SO2↑+2HCl↑
SO2↑+2HCl↑
(1)“酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为_________________。
检验“酸浸”后浸出液中的Fe3+可用____________溶液。
(2)“氧化”时发生反应的离子方程式为____________________________。
(3)“滤渣2”的主要成分为________(填化学式);“调pH”时,pH不能过高,其原因是________________。
(4)“加热脱水”时,加入SOCl2的目的是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com