
| 硫酸亚铁片 英文名:Ferrous Sulfate Tablets 本品含硫酸亚铁(FeSO4•7H2O)应为标示量的95.0%~110.0% | 氢氧化铝片 英文名:Aluminium Hydroxide Tablets |
| 【主要成分】糖衣、碳酸镁、氢氧化铝、淀粉 | |
| 【性状】本品为糖衣,除去糖衣后显淡绿色 | 【适应症】能缓解胃酸过多 |
| 【鉴别】取本品,除去糖衣,称取适量(约相当于硫酸亚铁片0.2g),加稀盐酸1滴与水20ml,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应 | 【用法用量】成人:口服,一次0.6~0.9g(一次2~3片),一日3次,餐前1小时服用 |
| 【详细用法】详见说明书 |
分析 Ⅰ.(1)空气中的氧气具有氧化性,亚铁离子具有强还原性,据此分析作答;
(2)硫酸亚铁中的亚铁离子具有较强还原性,容易被氧化成铁离子,可以通过加入硫氰化钾溶液检验是否存在铁离子,进行判断硫酸亚铁是否变质;
(3)硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生;
(4)亚铁离子在水溶液中易发生水解;
Ⅱ.(1)该药片能缓解胃酸过多,胃酸的主要成分是盐酸,能与盐酸反应的物质为有效成分;
(2)氢氧化铝与盐酸反应生成氯化铝与水;
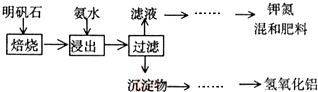
(3)①过滤操作选择玻璃仪器主要有烧杯、玻璃棒、漏斗;
②根据溶液稀释过程中溶质的物质的量不变计算出需要浓氨水的体积;根据配制的溶液体积选择容量瓶规格;
③根据题干信息及氨水与铝离子反应生成了氢氧化铝判断沉淀物成分;
④依据铝元素守恒计算.
解答 解:Ⅰ.(1)亚铁离子具有强还原性,容易被空气中的氧气氧化,糖衣可以隔绝空气,防止亚铁离子被氧气氧化,
故答案为:隔绝空气,防止FeSO4被空气氧化;
(2)硫酸亚铁若是变质,亚铁离子会被氧化成铁离子,所以可使用KSCN溶液检验,加入硫氰化钾,若溶液变成红色,证明硫酸亚铁已经变质,若溶液没有变成红色,证明硫酸亚铁没有变质,
故答案为:KSCN溶液;
(3)硫酸根离子的检验:向溶液中加入盐酸使之酸化,再加入BaCl2溶液,有白色沉淀产生,方程式为SO42-+Ba2+=BaSO4↓,
故答案为:Ba2++SO42-→BaSO4↓;
(4)亚铁离子在水溶液中易水解,加盐酸增大氢离子浓度可以抑制水解,故答案为:B;
Ⅱ.(1)该药片能缓解胃酸过多,胃酸的注意成分是盐酸,MgCO3、Al(OH)3与盐酸反应是有效成分,故答案为:MgCO3、Al(OH)3;
(2)氢氧化铝与胃酸中盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(3)①制备过程中多次用到过滤操作,在实验室中该操作所需的玻璃仪器除了烧杯、漏斗外,还需玻璃棒,故答案为:玻璃棒;
②配制500mL稀氨水(每升含有39.20g氨),需要使用500mL容量瓶,需要浓氨水(每升含有250.28g氨)的体积为:$\frac{39.20g×0.5L}{250.28g}$≈0.078L=78mL,选择100ml的量筒来量取溶液,
故答案为:78;100;
③明矾石的组成和明矾相似,所以能够与氨水反应生成氢氧化铝沉淀,还含有氧化铝和少量氧化铁杂质不与氨水反应也不容易水,所以沉淀物为:Al(OH)3、Al2O3、Fe2O3,
故答案为:Al(OH)3、Al2O3、Fe2O3;
④为测定明矾石中铝元素的含量,称取m g 明矾石样品按上述流程制得氢氧化铝n g(假设整个流程中既无铝元素损失,也无铝元素的引入),n(Al(OH)3)=$\frac{ng}{78g/mol}$,铝元素守恒,则该明矾石样品中铝元素的质量分数=$\frac{\frac{n}{78}mol×27g/mol}{mg}$×100%=$\frac{27n}{78m}$×100%,故答案为:$\frac{27n}{78m}$×100%.
点评 本题考查补铁剂和胃药的有关知识,考查了硫酸根离子、铁离子、亚铁离子的检验方法,氢氧化铝的性质,注意掌握常见离子的检验方法,试题培养了学生灵活应用所学知识解决实际问题的能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cu和Zn | B. | Na和Ag | C. | Fe和Ca | D. | Cu和Ca |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.
,属于两性氢氧化物的电离方程式Al3++3OH-?Al(OH)3 ?H++AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com