
【题目】某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。

(实验探究)
(1) A中制备氨气的化学反应方程式_________
(2)A中的反应___________(填“是”或“不是”)氧化还原反应。
(3)A装置还可用于制取气体___________ (只填一种)
(4)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是_____ L
(5)实验室收集氨气的方法是___________
(6)检验氨气的方法是__________
(7)C、D装置中颜色会发生变化的是___________ (填“C”或“D”)
(8)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是___________
(9)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是___________ (填“F”或“G”)。
(知识拓展)
(10)生石灰与水反应生成Ca(OH)2并放出热量化学方程式 [CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 ___________ 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
(知识应用)
(11)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救为法? ____________
【答案】2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O 不是 氧气 4.48 向上排空气法 用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则为氨气 D 有白烟生成 F AB 用湿毛巾捂住口鼻
2NH3↑+CaCl2+2H2O 不是 氧气 4.48 向上排空气法 用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则为氨气 D 有白烟生成 F AB 用湿毛巾捂住口鼻
【解析】
(1)A中发生反应是制备氨气的反应,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O;
2NH3↑+CaCl2+2H2O;
(2)反应前后化合价均未发生变化,故2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O不是氧化还原反应,故答案为:不是;
2NH3↑+CaCl2+2H2O不是氧化还原反应,故答案为:不是;
(3)实验装置为固固加热型,还可以用来制备氧气,如高锰酸钾制氧气,故答案为:氧气;
(4)有题意可知![]() ,根据反应方程式可知,n(NH3)=n(NH4Cl)=0.2mol,故
,根据反应方程式可知,n(NH3)=n(NH4Cl)=0.2mol,故![]() ,故答案为:4.48;
,故答案为:4.48;
(5)氨气易溶于水,密度比空气小,所以用向下排空气法收集,故答案为:向下排空气法;
(6)可以用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则为氨气,故答案为:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝,则为氨气;
(7)氨气能使湿润的红色石蕊试纸变蓝,所以D中颜色发生变化,故答案为:D;
(8)氨气与挥发的HCl会生成氯化铵晶体,所以有白烟生产,故答案为:有白烟生成;
(9)因为氨气极易溶于水,所以吸收氨气时要用防倒吸装置,故答案为:F;
(10)碱石灰和NaOH固体溶于水会放出大量热,所以可以用碱石灰和NaOH固体代替生石灰,故答案为:AB。
(11)根据NH3可以溶于水的性质,可选用湿毛巾捂住口鼻,故答案为:用湿毛巾捂住口鼻。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3其核磁共振谱中给出的峰值(信号)有两个。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是_________(多选扣分)。
A.CH3CH3 B. CH3COOH
C. CH3COOCH3 D. CH3OCH3
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为:____________,写出A在NaOH水溶液中反应的化学方程式_________________。请预测B的核磁共振氢谱上有 _________________个峰(信号)。
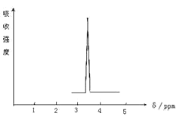
(3)写出乙醇的催化氧化化学方程式______ 。写出卤代烃消去反应的条件_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
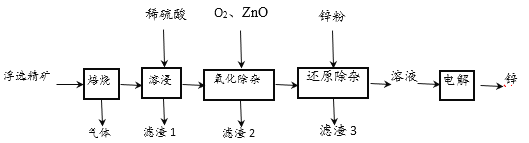
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
相关金属离子[c (Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | x | 8.3 | 8.2 | 9.4 |
常温下,Ksp[Fe(OH)3]=1×10-38,溶液中当离子浓度小于1×10-5mol/L时可认为沉淀完全。回答下列问题:
(1)用稀硫酸溶浸时,产生PbSO4和SiO2沉淀,经过滤后,向滤液中加入O2、ZnO,目的是除去杂质Fe2+、Fe3+,则氧化除杂工序中ZnO的作用是调节溶液的pH,应调节溶液的pH的范围为_______(填数值)。
(2)用铂电极电解硫酸锌溶液制备单质锌时,电解的总反应为________,电解使锌沉积后,电解液可返回_______工序循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 水、乙醇、乙酸都属于弱电解质
B. 苯与氯气生成 的反应属于取代反应
的反应属于取代反应
C. 分子式为C9H12的芳香烃共有8种
D. 淀粉、油脂、蛋白质都属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH4+含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O![]() (M=958 g·mol-1)含量测定
(M=958 g·mol-1)含量测定
步骤1:准确称取0.3636 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O![]() 完全转化为VO2+。
完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
(1)已知相关的化学键键能数据如下:
化学键 | H-H | C-O | | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=______kJ·mol-1(用数值表示),则△H3=______kJ·mol-1(用△H1和△H2表示)。
(2)向恒温、恒容密闭容器中充入一定量的CO(g)和H2(g)进行①反应,下列能说明反应达到平衡状态的是_____(填编号,下同)。
a.体系压强保持不变
b.v正(CO) = v逆(H2)
c.CO与CH3OH的物质的量之比保持不变
d.每消耗1molCO的同时生成1molCH3OH
e.混合气体的密度保持不变
(3)向同温、同体积的甲、乙、丙三个密闭容器中分别充入气体进行①反应。甲容器:2mol H2和1molCO;乙容器:1mol H2和0.5mol CO;丙容器:1mol CH3OH。恒温、恒容下反应达平衡时,下列关系正确的是________。
a.转化率:甲>乙 b.反应放出的热量数值Q:Q甲 = 2Q乙
c.CO的质量m:m甲= m丙> 2m乙 d.容器内压强P:P甲=P丙<2P乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AG=lgc(H+)/c(OH-),室温下用0.01mol·L1 NH3·H2O溶液滴定20.00mL 0.01mol·L1某一元酸HA,可得下图所示的结果,下列说法中错误的是
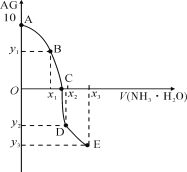
A. 该滴定实验最好选用甲基橙作指示剂
B. 整个过程中,C点时水的电离程度最大
C. 若x3=30,则有:3c(OH)=c(NH4+)+3c(H+)-2c(NH3·H2O)
D. A→C的过程中,可存在:c(A)>c(H+)>c(NH)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com