
【题目】利用核磁共振技术测定有机物分子的三维结构的研究获得了2002年诺贝尔化学奖。在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值(信号)可以确定有机物分子中氢原子的种类和数目。例如二乙醚的结构简式为:CH3—CH2—O—CH2—CH3其核磁共振谱中给出的峰值(信号)有两个。
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是_________(多选扣分)。
A.CH3CH3 B. CH3COOH
C. CH3COOCH3 D. CH3OCH3
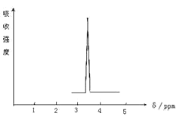
(2)化合物A和B的分子式都是C2H4Br2, A的核磁共振氢谱图如图所示,则A的结构简式为:____________,写出A在NaOH水溶液中反应的化学方程式_________________。请预测B的核磁共振氢谱上有 _________________个峰(信号)。
(3)写出乙醇的催化氧化化学方程式______ 。写出卤代烃消去反应的条件_________。
【答案】AD BrCH2CH2Br BrCH2CH2Br+NaOH![]() HOCH2CH2OH+H2O 2 2CH3CH2OH+O2
HOCH2CH2OH+H2O 2 2CH3CH2OH+O2![]() 2CH3CHO+2H2O NaOH的乙醇溶液、加热
2CH3CHO+2H2O NaOH的乙醇溶液、加热
【解析】
(1)根据有机物的核磁共振氢谱分析;
(2)卤代烃在强碱的水溶液中加热发生水解反应;
(3)乙醇的催化氧化生成乙醛;卤代烃消去反应的条件为NaOH的乙醇溶液、加热。
(1)A.CH3CH3中只有一种H原子,选项A正确;
B.CH3COOH中有两种H原子,选项B错误;
C.CH3COOCH3中有两种H原子,选项C错误;
D.CH3OCH3中只有一种H原子,选项D正确;
答案选AD;
(2)核磁共振氢谱中只给出一种峰,说明该分子中只有1种H原子,则A的结构简式为BrCH2CH2Br,A在NaOH水溶液中反应的化学方程式为BrCH2CH2Br+NaOH![]() HOCH2CH2OH+H2O;B的结构简式为CH3CHBr2,有两种H原子,所以核磁共振氢谱上有2个峰;
HOCH2CH2OH+H2O;B的结构简式为CH3CHBr2,有两种H原子,所以核磁共振氢谱上有2个峰;
(3)乙醇的催化氧化生成乙醛,反应的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
卤代烃消去反应的条件为NaOH的乙醇溶液、加热。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
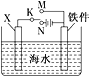
利用如图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①![]()
②![]()
③![]()
则下列叙述正确的是
A.由上述热化学方程式可知![]()
B.甲烷的燃烧热为![]()
C.![]()
![]()
D.若甲醇和甲烷的物质的量之比为![]() ,其完全燃烧生成
,其完全燃烧生成![]() 和
和![]() 时放出的热量为
时放出的热量为![]() ,则该混合物中甲醇的物质的量为
,则该混合物中甲醇的物质的量为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:

(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是_________,仪器a的名称是_______。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_________。
②同时c中有气体产生,该气体的作用是_____________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是________;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是___________、_________、洗涤、干燥。
(4)指出装置d可能存在的缺点______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有3步属于加成反应。(提示:路线⑤的反应可利用1,3-环己二烯与Br2的1,4-加成反应)请回答下列问题:

(1)分别写出B、C的结构简式:B_________、C_________。
(2)写出反应类型①___,④____,⑤____,⑥_________。
(3)写出反应①的化学方程式_______________。(有机物写结构简式,并注明反应条件)
(4)写出反应②的化学方程式______________(有机物写结构简式,并注明反应条件)
(5)写出反应⑥的化学方程式______________(有机物写结构简式,并注明反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯原子对O3分解有催化作用:①O3+Cl===ClO+O2 ΔH1,②ClO+O===Cl+O2 ΔH2。大气臭氧层的分解反应是③O3+O===2O2 ΔH,该反应的能量变化示意图如图所示,下列叙述中,正确的是( )

A.反应O3+O===2O2的ΔH=E1-E3B.反应O3+O===2O2的ΔH=E2-E3
C.O3+O===2O2是吸热反应D.ΔH=ΔH1+ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,回答下列小题。
铁放置时间长了就会生锈。铁容易生锈,除了由于它的化学性质活泼以外,同时与外界条件也有很大关系。水分是使铁容易生锈的物质之一。然而,光有水也不会使铁生锈,只有当空气中的氧气溶解在水里时,氧在有水的环境中与铁反应,才会生成一种叫氧化铁的东西,这就是铁锈,铁生锈总的反应为4Fe+3O2+xH2O![]() 2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
2Fe2O3·xH2O。铁锈是一种棕红色的物质,它不像铁那么坚硬,很容易脱落,一块铁完全生锈后,体积可胀大8倍。如果铁锈不除去,这海绵状的铁锈特别容易吸收水分,铁也就锈蚀的更快了。
【1】铁生锈总反应属于 ( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
【2】关于反应4Fe(OH)2+O2+2H2O![]() 4Fe(OH)3,下列说法正确的是 ( )
4Fe(OH)3,下列说法正确的是 ( )
A.O2发生还原反应
B.Fe(OH)2被还原
C.H2O发生氧化反应
D.H2O是氧化剂
【3】下列反应条件的改变对4Fe+3O2+xH2O![]() 2Fe2O3·xH2O速率的影响不正确的是( )
2Fe2O3·xH2O速率的影响不正确的是( )
A.增大O2的浓度能加快生锈速率
B.潮湿环境中铁生锈的速率更快
C.升高温度能加快生锈速率
D.干燥空气中铁生锈速率更快
【4】下列反应吸收热量的是 ( )
A.铁与稀盐酸反应
B.铁丝在氧气中燃烧
C.铝还原氧化铁
D.碳与二氧化碳反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学研究性学习小组利用以下装置制取并探究氨气的性质。

(实验探究)
(1) A中制备氨气的化学反应方程式_________
(2)A中的反应___________(填“是”或“不是”)氧化还原反应。
(3)A装置还可用于制取气体___________ (只填一种)
(4)若有10.7gNH4Cl固体,最多可制取NH3(标准状况)的体积是_____ L
(5)实验室收集氨气的方法是___________
(6)检验氨气的方法是__________
(7)C、D装置中颜色会发生变化的是___________ (填“C”或“D”)
(8)当实验进行一段时间后,挤压E装置中的胶头滴管,滴人1-2滴浓盐酸,可观察到的现象是___________
(9)为防止过量氨气造成空气污染,需要在上述装置的末端增加一个尾气处理装置,合适的装置是___________ (填“F”或“G”)。
(知识拓展)
(10)生石灰与水反应生成Ca(OH)2并放出热量化学方程式 [CaO+H2O==Ca(OH)2]。实验室利用此原理,往生石灰中滴加浓氨水,可以快速制取氨气。你认为生石灰可用下列 ___________ 物质代替(填序号)。
A.碱石灰(NaOH与CaO的固体混合物) B.NaOH 固体
C.硫酸溶液 D.石灰石(含CaCO3)
(知识应用)
(11)2010年11月9日晚,我省宁德市一冷冻厂发生氨气泄漏事件,500多居民深夜大转移。假如你在现场,你会采用什么自救为法? ____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com