
【题目】软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
软锰矿还原浸出的反应为:12MnO2+ C6H12O6+ 12H2SO4=12MnSO4+ CO2↑+18H2O
①该反应中,还原剂为__________。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3
往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_____________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq)![]() Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
Mn(OH)2(s) + CO32-(aq),t℃时,计算该反应的平衡常数K= (填数值)。
【答案】(1)8Al + 3Mn3O4![]() 4Al2O3+ 9Mn(2分)
4Al2O3+ 9Mn(2分)
(2)①C6H12O6(2分)升高反应温度(或将软锰矿研细等其他合理答案)(2分)
②>(2分)③Ca2+(2分)(3)Mn2++2HCO3-=MnCO3↓+ H2O + CO2↑(2分) 100(2分)
【解析】试题分析:(1)铝热反应的实质利用铝的强金属性,把弱金属性金属置换出来,8Al + 3Mn3O4![]() 4Al2O3+ 9Mn;
4Al2O3+ 9Mn;
(2)①还原剂是失电子,化合价升高被氧化,根据上述化合价的分析,C6H12O6中H为+1、O为-2,整个化合价的代数和为0,则C的化合价为0,CO2中C的化合价为+4价,即还原剂为C6H12O6,MnO2中Mn的化合价为+4价→+2价,提高还原浸出速率的措施为:升高温度、研细软锰矿等;②软锰矿还原浸出得到MnSO4溶液,说明浸出液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的pKsp为37.4与其他离子相比最大,pKsp=-lgKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-lgKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c2(OH-),c(OH-)≈10-10,c(H+)=1×10-4mol·L-1,pH=4,滤液1的pH大于MnSO4浸出液的pH;③向溶液中加热硫化铵,CuS的pKsp为35.2,可以将Cu2+形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后得到的含有锰离子的盐电解,可以达到金属锰;
(3)Mn2+和HCO3-发生成MnCO3、水和CO2,离子反应方程式为:Mn2++2HCO3-=MnCO3↓+ H2O + CO2↑,由MnCO3(s)+2OH-(aq)![]() Mn(OH)2(s)+CO32-(aq)可知,Ksp=c(CO32-)/c2(OH-)= [Ksp(MnCO3)/c(Mn2+)] /[Ksp(Mn(OH)2)/c(Mn2+)]=10-10.7/10-12.7=100。
Mn(OH)2(s)+CO32-(aq)可知,Ksp=c(CO32-)/c2(OH-)= [Ksp(MnCO3)/c(Mn2+)] /[Ksp(Mn(OH)2)/c(Mn2+)]=10-10.7/10-12.7=100。


科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s)+H2O(g)==CO(g)+H2(g) ΔH1=akJ/mol
②CO(g)+H2O(g)==CO2(g)+H2(g) ΔH2=bkJ/mol
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3=ckJ/mol
④2CH3OH(g)==CH3OCH3(g)+H2O(g) ΔH4=dkJ/mol
A. 反应①、②为反应③提供原料气,且a>0
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)==1/2CH3OCH3(g)+1/2H2O(g)的ΔH=d/2kJ/mol
D. 反应2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g)的ΔH=-(2b+2c+d)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下列有关说法正确的是
A.常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4 NA
B.4.48L氨气分子中含0.6NA个N-H键
C.铁、Cu片、稀硫酸组成的原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA
D.4℃时,20g2H216O中含有共用电子对数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3,4-二羟基肉桂酸(H)是为止血升白细胞药,用于肿瘤治疗的术后恢复,其合成路线如图所示。

已知:
请回答下列问题:
(1)X的名称为_______________,A中的官能团的名称是____________。
(2)Y+R→Z的化学方程式为____________。反应类型为____________。
(3)下列说法正确的是____________ (填字母)。
a.1 molH最多能和3 mol Br2反应
b.1个H分子中最多有8个碳原子共平面
c.乙烯在一定条件下与水发生加成反应生成X
d.有机物Z的分子式为C9H8O2Cl2
(4)T是H的芳香族同分异构体,1mol T与足量碳酸氢钠溶液反应生成2mol CO2,则T的结构有____________种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为____________ (写一种即可)。
(5)设计以甲醛、Y为原料合成C5H12O4 ( )的路线 (无机试剂任选) 。____________
)的路线 (无机试剂任选) 。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应,转化关系中有些反应的产物和反应的条件没有全部标出。
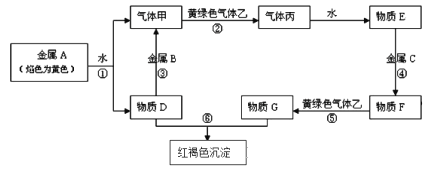
请根据以上信息回答下列问题:
(1)写出金属元素A在周期表中的位置:____________,物质D的电子式:____________。
(2)写出下列反应的离子方程式:反应③__________________________________;
反应⑤_______________________________________。
(3)检验物质G中阳离子的操作方法 ________________________________________。
(4)实验室制取黄绿色气体乙的化学方程式为 _________________________________,在该反应中如有0.5mol乙生成,转移电子的物质的量是______mol,制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为 ______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)<Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,pH变化曲线如图丙所示(忽略温度变化),则①点c(CH3COO-)>c(Na+)>c(CH3COOH)
D. 图丁表示反应N2(g)+3H2(g)![]() 2NH3(g)平衡时NH3体积分数随起始
2NH3(g)平衡时NH3体积分数随起始![]() 变化的曲线,则转化率:αA(H2)=αB(H2)
变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆的多价稀有金属,性质很稳定。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是

A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH 溶液,用于除去HCl
C. 结束反应时,先关闭活塞K,再停止加热
D. 启普发生器不可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com