
(14分)铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2  2Cu + SO2
2Cu + SO2
方法二:湿法炼铜:CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下: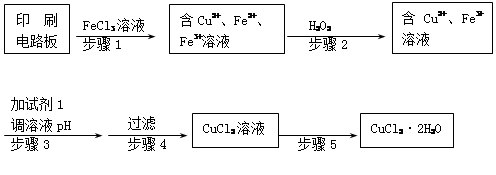
①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
下列实验叙述正确的是( )
| A.新制氯水放置数天,溶液中的Cl2分子数目不变 |
| B.久置的氯水可使蓝色石蕊试纸先变红后褪色 |
| C.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| D.钠投入硫酸铜溶液中有红色粉末产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将分别含有甲、乙两种常见金属元素的两种正盐A和B的混合物溶于水,通入氯气,然后向反应后的溶液中加入四氯化碳并振荡、静置,溶液分层,下层液体呈橙红色。若在该混合物的溶液中滴加一定浓度的氨水至过量,可得到白色沉淀C。向沉淀C加入过量NaOH溶液,沉淀部分溶解,剩余白色沉淀D。将D溶于盐酸,可得到A溶液;将D灼烧可得到优质的耐高温材料。
(1)试写出A和B的化学式:A ,B 。
(2)元素乙的单质可与某黑色固体反应置换出熔融态的铁,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色非氯净水消毒剂和高容量电池材料。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下: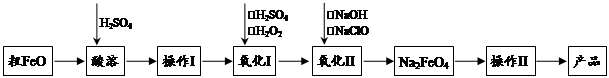
已知:NaClO不稳定,受热易分解。回答下列问题:
(1)高铁酸钠(Na2FeO4)中铁元素的化合价为 。
粗FeO酸溶过程中通入高温水蒸气,其目的是 。
(2)操作Ⅰ目的是得到高纯度FeSO4溶液,氧化Ⅰ后的溶液中如果滴加KSCN溶液,溶液变为血红色,由此推测氧化Ⅰ反应的离子方程式为 。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备:
①Cl2与NaOH溶液反应的化学方程式为_____________________________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/0C | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。
(1)钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
(2)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为 mol。
(3)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有 。
a.KCl b. KClO3 c. MnO2 d. Mg
取少量铝热反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象, (填“能”或“不能”)说明固体混合物中无Fe2O3,理由是 (用离子方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下: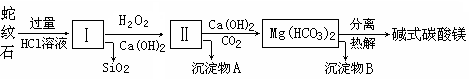
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下: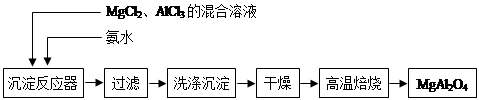
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。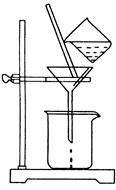
(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。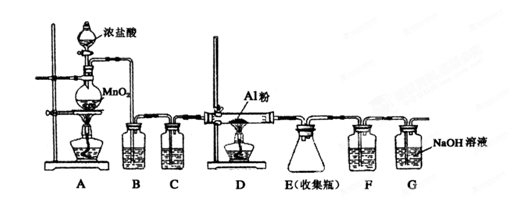
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如下: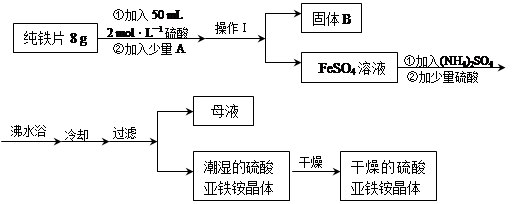
请回答下列问题:
(1)操作Ⅰ的名称是 ,所用主要仪器和用品有(铁架台、铁圈除外) 。
(2)若A物质为CuSO4,其加入的目的是 ,则固体B的成分为 。
(3)加少量硫酸可以调节pH为 1~2,其作用是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com