
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数为3:2
B. 1L CO的质量一定比1L O2的质量小
C. 标准状况下,将3.36 L Cl2通入1 L0.2 mol/L FeBr2溶液中,被氧化的Br数目为0.1NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
【答案】C
【解析】A、等物质的量的NaN3和Na2O2中所含阴离子N3-与O22-的个数比为1:1,选项A错误;B、氧气的摩尔质量大,但CO与氧气所处的状态下的气体摩尔体积不一定相同,故1LCO与1L氮气的物质的量不一定相等,则二者质量不能确定,选项B错误;C、标准状况下,将3.36 L Cl2为0.15mol,通入1 L0.2 mol/L FeBr2溶液中,先氧化0.2mol亚铁离子,消耗0.1mol氯气,剩余0.5mol氧气将0.1molBr-氧化,则被氧化的Br-为0.1NA,选项C正确;D、标准状况下,11 g由3H和16O组成的超重水物质的量为![]() =0.5mol,中子数和电子数之和为[(2×2+8)+(1×2+8)]×0.5NA =11NA,选项D错误。答案选C。
=0.5mol,中子数和电子数之和为[(2×2+8)+(1×2+8)]×0.5NA =11NA,选项D错误。答案选C。


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】请认真审题并作答:
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_______________________。CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和CO2,由此可以推知CN22-的空间构型为__________________。
(2)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过______________结合。在肾脏内易形成结石。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为_________。
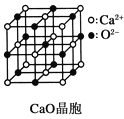
(4)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401kJ·mol-1、NaCl 786kJ·mol-1。导致两者晶格能差异的主要原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对原子结构的认识顺序正确的是( ) ①道尔顿原子模型 ②汤姆生原子模型 ③卢瑟福原子模型 ④电子云模型.
A.①③②④
B.④①②③
C.④②③①
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
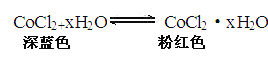
现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。
(1)水合物中x=______;
(2)若该化合物中Co2+的配位数为6,而且经测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为:______
(Ⅱ)在极性分子中,正电荷中心同负电荷中心间的距离称为偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。
①试在方框中画出两种异构体的构型图:_________;___________________
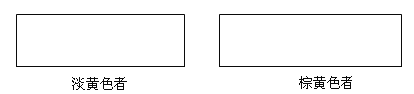
②该化合物的两种异构体在水中溶解度较大的是___________________(填“棕黄色者”或“淡黄色者”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中:①pH试纸的使用;②过滤;③蒸发;④配制一定物质的量浓度溶液。均用到的仪器是
A. 蒸发皿 B. 玻璃棒 C. 试管 D. 分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)已知:2NO(g)+O2(g) ![]() 2NO2(g) △H=-113.0 kJ mol-1
2NO2(g) △H=-113.0 kJ mol-1
2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196. 6 kJ mol-1
2SO3(g) △H=-196. 6 kJ mol-1
则NO2(g)+SO2(g) ![]() SO3(g)+N0(g) △H= ________.
SO3(g)+N0(g) △H= ________.
(2)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收N02时,发生的反应为:
2NO2+2OH- =NO2- +NO3- +H2O,反应中形成的化学键是________(填化学键的类型);用NaOH溶液吸收少量SO2的离子方程式为____________。
(3)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2) : n0 (SO2)] 进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率[a(NO2)]。 部分实验结果如图所示:
①当容器内_______(填标号)不再随时间的变化而改变时,可以不断反应达到了化学平衡状态。
a.气体的压强
b.气体的平均摩尔质量
c.气体的密度
d.NO2的体积分数
②如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是________。

③若A点对应实验中,S02(g)的起始浓度为c0 molL-1 ,经过t min达到平衡状态,该时段化学反应速率![]() (N02)= _________molL-1min -1.
(N02)= _________molL-1min -1.
④图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断::Tc_____Td(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。

①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:

①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g) ΔH =-515kJ/mol
①C3H6(g)+ O2(g)=C3H4O(g)+H2O(g) ΔH =-353kJ/mol
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应温度为460℃。低于460℃时,丙烯腈的产率________(填“是”或者“不是”)对应温度下的平衡产率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号)
A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是_______________。进料氨、空气、丙烯的理论体积约为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com