
【题目】(I)无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
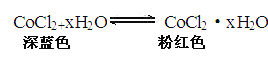
现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。
(1)水合物中x=______;
(2)若该化合物中Co2+的配位数为6,而且经测定得知内界和外界占有Cl-的个数比为1:1,则其化学式可表示为:______
(Ⅱ)在极性分子中,正电荷中心同负电荷中心间的距离称为偶极长,通常用d表示。极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
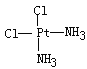
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上。已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0。
①试在方框中画出两种异构体的构型图:_________;___________________
②该化合物的两种异构体在水中溶解度较大的是___________________(填“棕黄色者”或“淡黄色者”)。
【答案】 6 [CoCl(H2O)5]Cl·H2O 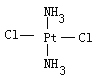
 棕黄色者
棕黄色者
【解析】本题考查配位键及配位化合物,同分异构体等知识,必须审清题目信息,并与所学知识结合起来进行解答。
(1)xH2O+CoCl2=CoCl2·xH2O △m
131+18x 18x
119g (119-65)g
(131+18x):18x=119:(119-65),解得:x=6。
(2)该化合物CoCl2·6H2O中Co2+配位数为6,而且经定量测定得知内界和外界占有Cl-个数为1:1,即各有1个氯离子,则内界中含有1个氯离子和5个水分子,外界有1个氯离子,另外还有1个结晶水,所以化学式可表示为[CoCl(H2O)5]Cl·H2O。
(3)①根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,即正负电荷重心重合,所以淡黄色者是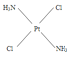 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,所以棕黄色者是
;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,所以棕黄色者是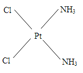 ;②根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者。
;②根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为___________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为_______________。
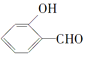 的沸点比
的沸点比![]() 高,原因是______________________。
高,原因是______________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为________________。
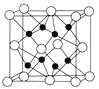
(4)CaF2离子晶体的晶胞结构如图所示。该离子化合物晶胞的边长为a cm,则晶体的密度是_____________g/cm3(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种高能燃料,也广范应用在工业合成中。
(1)标准摩尔生成焓是指在25℃和101kPa,最稳定的单质生成1 mol化合物的焓变。已知25℃和101kPa时下列反应:
①2C2H6(g)+7O2(g)=4CO2(g)+6H2O(l) △H=-3116kJ·mol-1
②C(石墨,s)+O2(g)=CO2(g) △H=-393.5 kJ·mol-1
③2H2(g)+02(g)=2H2O(l),△H=-571.6 kJ·mol-1
写出乙烷标准生成焓的热化学方程式:_____________。
(2)已知合成氨的反应为:N2+3H2![]() 2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:
2NH3 △H <0。某温度下,若将1molN2和2.8molH2分别投入到初始体积为2L的恒温恒容、恒温恒压和恒容绝热的三个密闭容器中,测得反应过程中三个容器(用a、b、c表示)内N2的转化率随时间的变化如图所示,请回答下列问题:

①图中代表反应在恒容绝热容器中进行的曲线是______(用a、b、c表示)。
②曲线a条件下该反应的平衡常数K=__________________。
③b容器中M点,v(正)_____ v(逆)(填“大于”、“小于”.或“等于”)。
(3)利用氨气可以设计成高能环保燃料电池,用该电池电解含有NO2-的碱性工业废水,在阴极产生N2。阴极电极反应式为_____;标准状况下,当阴极收集到1l.2LN2时,理论上消耗NH3的体积为_______。
(4)氨水是制备铜氨溶液的常用试剂,通过以下反应及数据来探究配制铜氨溶液的最佳途径。
已知:Cu(OH)2(s)![]() Cu2++2OH- Ksp=2.2×10-20
Cu2++2OH- Ksp=2.2×10-20
Cu2++4NH3·H2O![]() [Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
[Cu(NH3)4]2+(深蓝色)+4H2O Kβ=7.24×1012
①请用数据说明利用该反应:Cu(OH)2(s)+4NH3·H2O![]() [Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
[Cu(NH3)4]2++4H2O+2OH- 配制铜氨溶液是否可行:________________。
②已知反应Cu(OH)2(s)+2NH3·H2O+2NH4+![]() [Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
[Cu(NH3)4]2++4H2O K=5.16×102。向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液;此时若加入适量的硫酸铵固体,出现的现象为__________;解释出现该现象的原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是
A. 等物质的量的NaN3和Na2O2中所含阴离子数为3:2
B. 1L CO的质量一定比1L O2的质量小
C. 标准状况下,将3.36 L Cl2通入1 L0.2 mol/L FeBr2溶液中,被氧化的Br数目为0.1NA
D. 标准状况下,11 g由3H和16O组成的超重水中,中子数和电子数之和为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、HCO3﹣、NO3﹣
B.NH4+、SO42﹣、Al3+、NO3﹣
C.Na+、Ca2+、NO3﹣、CO32﹣
D.K+、MnO4﹣、NH4+、NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com