
����Ŀ��ij�¶�ʱ�������Ϊ1L���ܱ������У�A��B��C��������Ũ�ȵı仯��ͼI��ʾ���������������䣬���¶ȷֱ�ΪTl��T2ʱ��B������ٷֺ�����ʱ���ϵ��ͼ����ʾ�������н�����ȷ���ǣ�������

A.�÷�Ӧ���Ȼ�ѧ����ʽΪ��A��g ��+3B��g�� 2C��g������H��0
B.�ﵽƽ����������������䣬ͨ��ϡ�����壬ƽ��������Ӧ�����ƶ�
C.�ﵽƽ����������������䣬��С�����ƽ�����淴Ӧ�����ƶ�
D.�������������䣬�����¶ȣ������淴Ӧ���ʾ�����A��ת���ʼ�С
���𰸡�D
��������A������ͼ��AŨ�ȼ�С�ˣ�0.5��0.3��mol/L=0.2mol/L��BŨ�ȼ�С�ˣ�0.7��0.1��mol/L=0.6mol/L������A��BΪ��Ӧ�C��Ũ��������0.4mol/L������CΪ��������ǵı仯��֮��Ϊ0.2��0.6��0.4=1��3��2����Ӧ�и����ʼ�����֮�ȵ������ʵ�Ũ�ȵı仯��֮�ȣ�д����ѧ����ʽΪA��g ��+3B��g��2C��g��������ͼ���֪��T1��T2 �� ����ʱB�����������ƽ�������ƶ������Ը÷�Ӧ������ӦΪ���ȷ�Ӧ��H��0����A����
B������������ͨϡ�����壬��Ӧ�еĸ����ʵ�Ũ�Ȳ��䣬����ƽ�ⲻ�ƶ�����B����
C����С���ƽ���������С�ķ����ƶ������ݷ�ӦA��g ��+3B��g��2C��g����֪��ƽ��������Ӧ�����ƶ�����C����
D�������¶����淴Ӧ���ʾ����÷�ӦΪ���ȷ�Ӧ��ƽ�����淴Ӧ�����ƶ���A��ת���ʼ�С����D��ȷ������ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£�H2O2��ˮ��Һ�з����ֽⷴӦ��2H2O2![]() 2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
2H2O+O2����Ӧ�����У���ò�ͬʱ��H2O2�����ʵ���Ũ�����±���
t/min | 0 | 20 | 40 | 60 | 80 |
c��H2O2��/molL��1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
�� H2O2�ķֽⷴӦ������ԭ��Ӧ����ǡ����ǡ�����
�ڸ÷ֽⷴӦ0��20min��ƽ����Ӧ����v��H2O2��ΪmolL��1 min��1 ��
�������Ӧ���õ�H2O2��ҺΪ100mL������O2g��
A��0.08 B��0.16 C��1.28 D��2.4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���ǻ�ѧʵ�����еij���װ�ã����ж�����;�����¸�����;�Ͳ�������ȷ����������ţ��� 
a��ϴ�������װ�ã�ƿ�ڷ�һ�������Һ����a�ܿڽ���
b�������ռ�������ˮ�����壺ƿ�ڳ���ˮ����b�ܿڽ���
c���ṩ����CO��ƿ�ڳ���CO��b�ܿڽ�����ˮ��ͷ
d��H2S��SO2��Ӧ��װ�ã���a�ܿ�ͨ��H2S��b�ܿ�ͨ��SO2
e����������ʱ���ڹ۲������ٶȣ�ƿ��װ����ˮ��b�Ӳ��˱�ǻ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1mol������������1Lˮ�г�ֽ������Һ����������������
A. KCl B. Mg(OH)2 C. Na2CO3 D. MgSO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У����������Ժ��ֱ�����ϣ�ֻҪ�����ʵ���һ�������ȼ�պ�������������Ҳһ������( )
A. C2H2��C6H6B. C2H6O��C3H6O2
C. CH2O��C2H4O2D. C3H8��C4H8O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ɢϵ����Һ����Һ���ı���������
A. ��ɢ�����ӵĴ�С B. ��ϵ�Ƿ��ȶ� C. ��û�ж����ЧӦ D. �����Ƿ���е��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ��ϡH2SO4���ձ��з����õ������ӵ�пƬ��ͭƬ������������ȷ����( )��
A. ��������SO42-Ũ��������B. ����ͨ��������ͭƬ����пƬ
C. ������ӦʽΪZn��2e��===Zn2��D. ��ԭ��ع��������е������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ַǻ������ȵ��شٷ��ڵ�ҩ������������߱�����ʱ��졢ҩЧ�ߡ���ҩ���Ͱ�ȫ���ܸߵ��ŵ㣮�����ɱ���ȩ��A��Ϊԭ�Ϻϳɣ����ֺϳ�·�����£� 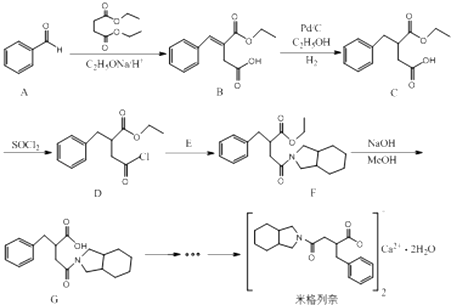
��ش��������⣺
��1��������C�к���������Ϊ���������ƣ���
��2����B��C��F��G�ķ�Ӧ��������Ϊ�� ��
��3��D��E����ȡ����Ӧ����F��ͬʱ��HCl���ɣ���E�Ľṹ��ʽ�� ��
��4��X �� 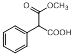 ��ΪC��ͬϵ�д����������������X��һ��ͬ���칹��Ľṹ��ʽ�� ��
��ΪC��ͬϵ�д����������������X��һ��ͬ���칹��Ľṹ��ʽ�� ��
���ܷ���������Ӧ����FeCl3��������ɫ��Ӧ������ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ��
�˴Ź�������ͼ����4�����շ壮
��5����֪���� ![]()
�ڸ�������֪ʶ����������Ϣ��д���� 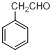 Ϊԭ���Ʊ�
Ϊԭ���Ʊ�  �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
H2C=CH2 ![]() CH3CH2Br
CH3CH2Br ![]() CH3CH2OH��
CH3CH2OH��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com