
【题目】在元素周期表中,在金属元素与非金属元素的分界线附近可以找到( )
A.作为催化剂的材料
B.电子工业上的半导体材料
C.制造农药的材料
D.制造耐高温材料
科目:高中化学 来源: 题型:
【题目】实验室制备一硝基甲笨(主要含邻硝基甲苯和对硝基甲苯)的反应原理、实验装
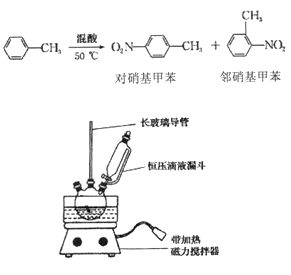
密度/(g·cm-3) | 沸点/℃ | 式量 | 溶解性 | |
甲苯 | 0.866 | 110.6 | 92 | 不溶于水,易溶于一硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 137 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 137 | 不溶于水,易溶于液态烃 |
实验步骤:
① 配制混酸,组装如图反应装置。取100 mL 烧杯,用10 mL 浓硫酸与30 mL 浓硝酸配
制混酸,加入恒压滴液漏斗中,把15 mL 甲苯(折合质量13.0g)加入三颈烧瓶中。
② 向室温下的甲苯中逐滴加混酸,边滴边搅拌,混合均匀。
③ 在50一60℃ 下发生反应,直至反应结束。
④ 除去混酸后,依次用蒸馏水和10% NaCO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
请回答下列问题:
(l)配制40mL 混酸的操作是________________
(2)装置中还缺少__________(填仪器名称)。如果温度超过60℃,将会有____(填物质名称)生成。
(3)分离粗产品和水的操作方法是__________
(4)产品用10% NaCO3溶液洗涤之后,再用蒸馏水洗涤,检验产品是否洗干净的操作是_______
(5)为了得到更纯净的硝基苯,还须先向液体中加入_______除去水,然后蒸馏,若最终得到产品的质量为13.70g,则一硝基甲苯的产率是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热也是△H=-57.3kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:

回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式__________________________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在250C某稀溶液中,由水电离产生的c(H+)=10-13mol/L,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH可能为1 D.该溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从2008年6月1日起,各大超市、农贸市场不得提供免费的塑料袋。下列说法中不正确的是( )
A. 这一举措的目的是为了限制和减少塑料袋的使用,遏制“白色污染”
B. 塑料、合成纤维、合成橡胶是三大合成材料
C. 线型结构的塑料具有热塑性(加热变形,冷却后定形)
D. 塑料、纤维素、蛋白质、天然橡胶属于天然高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于金属腐蚀和防护的说法不正确的是( )
A. 金属腐蚀过程中发生了化学反应
B. 在铁表面镀锌可对铁起保护作用
C. 在铁船壳上镶嵌铜块能减缓船体的腐蚀
D. 铝制品在空气中不易被腐蚀,是因其铝的化学性质很稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
H2(g)+![]() O2(g) = H2O(1) △H2=bkJmol-1
O2(g) = H2O(1) △H2=bkJmol-1
H2O(g) = H2O(l) △H3=ckJmol-1
则 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=__________kJmol-1
CH3OH(g)+H2O(g) △H=__________kJmol-1
(2)CO2催化加氢也能合成低碳烯烃: 2CO2(g)+6H2(g)![]() C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。
C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。

(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应 A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+ H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。

① 由图2可知温度升高CO的产率上升,其主要原因可能是__________________。
② 由图2可知获取CH3OH最适宜的温度是________________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__________________。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(4)在催化剂表面通过施加电压可将溶解在水中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为______________________________________________________。
(5)由CO2制取C的太阳能工艺如图3所示。“热分解系统”发生的反应为:2Fe3O4![]() 6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com