
A、Ba2+,Cu2+,Br-,NO
| ||||
B、Na+,Ca2+,HCO
| ||||
C、K+,Fe2+,SO
| ||||
D、Na+,K+,NO
|
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、CuSO4溶液与Ba(OH)2溶液反应:Cu2++2OH-═Cu(OH)2↓ |
| B、氢氧化铝中和胃酸:OH-+H+═H2O |
| C、NaHSO4溶液与KOH溶液反应:H++OH-═H2O |
| D、AgNO3溶液与NaCl溶液反应:AgNO3+Cl-═AgCl↓+NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阿司匹林--解热镇痛药 |
| B、NaOH--抗酸药 |
| C、麻黄素--兴奋剂 |
| D、青霉素--消炎药 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸氢钠溶液中滴入Ba(OH)2溶液使所得溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| B、成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+═Cl2↑+H2O |
| C、向苯酚钠溶液中通入少量的CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| D、向碱性KMnO4溶液中滴加HCOOK溶液:2MnO4-+HCOO-+OH-═MnO42-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
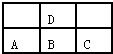 如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )
如图是元素周期表短周期的一部分,若A原子最外层的电子数比次外层的电子数少3,则下列说法中正确的是( )| A、D与C不能形成化合物 |
| B、D的最高正价与B的最高正价相等 |
| C、A、B、C的最高价氧化物对应的水化物酸性强弱的关系是C>B>A |
| D、A、B、C、D原子所具有的原子轨道类型和数目都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
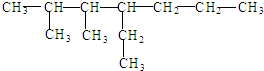 的命名中正确的是( )
的命名中正确的是( )| A、2,3-二甲基-4-丙基己烷 |
| B、2,3-二甲基-4-乙基庚烷 |
| C、4-乙基-2,3-二甲基庚烷 |
| D、5,6-二甲基-4-乙基庚烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com