
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
【答案】B
【解析】A. 平衡常数只与温度有关,温度不变,同一反应的平衡常数不变,故A错误;B. ①容器中放出23.15kJ的热量,则由反应方程式可知,生成氨气的物质的量为:23.15kJ÷92.6kJ/mol=0.5mol,根据三段式法有:
X2(g) + 3Y2(g) ![]() 2XY3(g)
2XY3(g)
起始(mol): 1 3 0
转化(mol): 0.25 0.75 0.5
平衡(mol): 0.75 2.25 0.5
可知平衡时①容器中X2、Y2和XY3的物质的量分别为0.75mol、2.25mol和0.5mol,将②按化学计量数之比换算成左边,与①对应物质的物质的量相等,恒温恒容下,两平衡是完全等效平衡,所以平衡时②容器中X2、Y2和XY3的物质的量也分别为0.75mol、2.25mol和0.5mol,此时XY3的物质的量浓度均为0.5mol÷0.25L=2mol/L,故B正确;C. 起始时容器②中XY3的物质的量浓度为0.8mol÷0.25L=3.2mol/L,由B计算可知容器②中反应达到平衡时,XY3的物质的量浓度为2mol/L,则起始时②的反应向逆反应方向进行,反应过程需要吸热,故C错误;D. 若容器①体积为0.20L,相当于减小体积,增大压强,平衡向正反应方向移动,放出热量多,故D错误;答案选B。


科目:高中化学 来源: 题型:
【题目】根据如图海水综合利用的工业流程图,判断下列说法正确的是( ) 
已知:MgCl26H2O受热生成Mg(OH)Cl和HCl气体等.
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质
B.在过程③中将MgCl26H2O灼烧即可制得无水MgCl2
C.在过程④、⑥反应中每氧化0.2 mol Br﹣需消耗2.24LCl2
D.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是
A. ![]() = 0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
= 0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
B. 能使pH试纸呈红色的溶液:K+、NH4+、I-、NO3-
C. 含大量Al3+的溶液中: Na+、 HCO3-、K+、 AlO2-
D. 由水电离产生的c(H+) =10-12mol/L的溶液中:Na+、Fe2+、SO42-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1.01×105 Pa、298K条件下,2mol H2燃烧生成水蒸气时放出484kJ热量.下列热化学方程式中正确的是( )
A.H2O(g)═H2(g)+ ![]() O2(g)△H=+242 kJ?mol﹣1
O2(g)△H=+242 kJ?mol﹣1
B.2H2(g)+O2(g)=2H2O(l)△H=﹣484 kJ?mol﹣1
C.H2O(g)+ ![]() O2(g)=H2O(g)△H=+242 kJ?mol﹣1
O2(g)=H2O(g)△H=+242 kJ?mol﹣1
D.2H2(g)+O2(g)═2H2O(g)△H=+484 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的平衡常数:
H2(g)+S(s)H2S(g),K1;
S(s)+O2(g)SO2(g),K2 .
则反应:H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数为( )
A.K1+K2
B.K﹣K2
C.K1×K2
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2SO4既属于钠盐又属于硫酸盐
B. CO2水溶液能导电,所以CO2是电解质
C. 氯化钠溶液在电流作用下电离成钠离子和氯离子
D. 向硝酸溶液中加入少量氢氧化钠固体,溶液的导电能力显著降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人造空气(氧气与氦气的混合气)可用于减轻某些病痛或供深水潜水员使用。标准状况下,11.2 L “人造空气”的质量是4.8g,其中氧气与氦气的质量比是
A. 1∶1 B. 2∶1 C. 1∶4 D. 2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一同学用某种粗盐进行提纯实验,步骤见下图.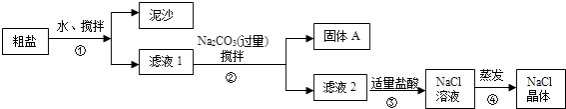
请回答:
(1)步骤①和②的操作名称是 .
(2)步骤③判断加入盐酸“适量”的方法是;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止 , 当蒸发皿中有较多量固体出现时,应 , 用余热使水分蒸干.
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 |
| 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含 | 取少量固体A于试管中,先滴入 , 再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, |
| 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:aA(g)+bB(g)cC(g)+dD(g);根据图1,2回答: 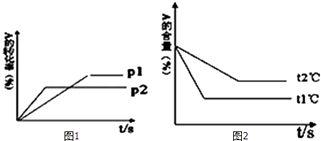
(1)压强 P1比P2(填“大”或“小”);
(2)(a+b)比(c+d)(填“大”或“小”);
(3)温度t1℃比t2℃(填“高”或“低”);
(4)正反应为反应(填“吸热”或“放热”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com