

| A. | 该反应热△H=(a-b) kJ•mol-1 | |
| B. | 每生成2 mol AB(g)吸收b kJ能量 | |
| C. | 该反应中反应物的总能量高于生成物的总能量 | |
| D. | 断裂1 mol A-A和1 mol B-B键,放出a kJ能量 |
分析 A.反应热△H=反应物能量总和-生成物能量总和;
B.依据图象分析判断1molA2和1molB2反应生成2molAB;
C.依据能量图象分析可知反应物能量低于生成物能量;
D.断裂化学键吸收能量.
解答 解:A.反应热△H=反应物能量总和-生成物能量总和,所以反应热△H=(a-b)kJ•mol-1,故A正确;
B.依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a-b) kJ热量,故B错误;
C.依据能量图象分析可知反应物能量低于生成物能量,故C错误;
D.断裂化学键吸收能量,则断裂1 mol A-A和1 mol B-B键,吸收a kJ能量,故D错误;
故选:A.
点评 本题考查了化学反应的能量变化,把握图象中数据的含义是解题的关键,注意反应热△H=反应物能量总和-生成物能量总和,题目较简单.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定有SO42- | B. | 可能有Ag+或SO42- | ||
| C. | 一定无Ag+ | D. | 一定有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
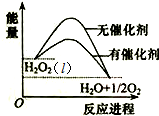
| A. | 加入催化剂,减小了反应的热效应(l) | |
| B. | 加入催化剂,不能提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2(l)═H2O(l)+$\frac{1}{2}$O2 (g)△H>0 | |
| D. | 无法比较反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
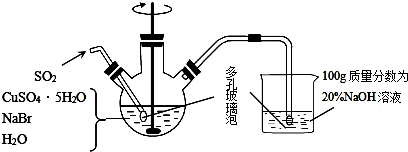
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
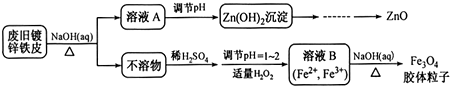
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com