
分析 Cu与硝酸反应生成硝酸铜、NO2、NO的混合气体,生成的NO2、NO 的混合气体与O2(标准状况)混合后通入水中,所有气体完全被水吸收又生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,进而计算消耗氧气体积.
解答 解:Cu与硝酸反应生成硝酸铜、NO2、NO的混合气体,生成的NO2、NO 的混合气体与O2(标准状况)混合后通入水中,所有气体完全被水吸收又生成硝酸,纵观整个过程,由电子转移守恒,可知Cu提供电子等于氧气获得的电子,Cu失去电子为$\frac{6.4g}{64g/mol}$×2=0.2mol,故消耗氧气为$\frac{0.2mol}{4}$=0.05mol,标况下消耗氧气体积为0.05mol×22.4L/mol=1.12L,
答:消耗氧气体积为1.12L.
点评 本题考查氧化还原反应计算,难度中等,侧重考查学生的分析思维能力与解题方法技巧,注意利用守恒法进行解答.


科目:高中化学 来源: 题型:解答题
| 检测内容 | 二氧化硫 | 二氧化氮 | PM10 | PM2.5 |
| 指数 | 28 | 24 | 103 | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
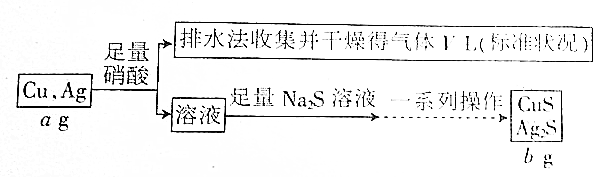
| A. | V L气体是NO | |
| B. | 一系列操作指“过滤、洗涤、烘干” | |
| C. | 上述数据之间的关系有b=$\frac{7a+15v}{7}$ | |
| D. | 根据上述数据能计算合金中铜的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 将氨气液化排出能加快反应速率 | D. | N2与H2不能完全转化为NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,实验中,可以观察到反应②的现象是:气体由无色变红棕色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com