
已知反应A2(g)+B2(g)=2AB(g),断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ(Q1、Q2、Q3均大于零),则下列说法正确的是 ( )
| A.若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热 |
| B.若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热 |
| C.若该反应为放热反应,则Q1+Q2 < Q3 |
| D.若该反应为吸热反应,则Q1+Q2 < Q3 |
科目:高中化学 来源: 题型:单选题
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的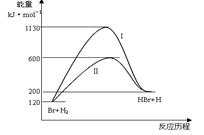
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列变化中生成物的总能量大于反应物的总能量的是( )
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列反应中属吸热反应的是
| A.铝与盐酸反应放出氢气 | B.氢氧化钠与盐酸的反应 |
| C.硫在空气或氧气中燃烧 | D.Ba(OH)2·8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列热化学方程式中,ΔH的绝对值能表示可燃物的燃烧热的是( )
A.C(s)+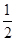 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 O2(g)===CO(g) ΔH=-110.5 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
D.CO(g)+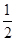 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)甲醇(CH3OH)被称为21世纪的新型燃料,以煤为原料制备甲醇的流程如下: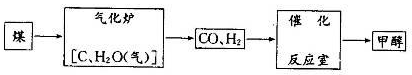
(1) 气化炉中主要反应的化学方程式为 。
(2)已知CO、H2、甲醇(l)的燃烧热分别为:—285.8 kJ/mol、—283 kJ/mol、—726.5 kJ/mol;
则CO和H2合成甲醇的热化学方程式为__ __
(3) -定条件下,在催化反应室中发生反应.CO(g)+2H2(g) =CH3OH(g)△H<0;
CO 的平衡转化率与温度、压强的关系如图所示。回答下列问题: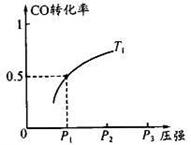
①工业上,上述反应温度不宜过高,原因是_ ___;
②若反应是1 mol CO与2 mol H2在2L容积中进行,则
T1、P1下,该反应的平衡常数为__ __;
维持温度、容积不变,催化反应室再增加l mol CO与2 mol
H2,达到新平衡时,CO的转化率____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: 。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修2:化学与技术】(15分)
第五主族的磷单质及其化合物在工业上有广泛应用。
(1)同磷灰石在高温下制备黄磷的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) 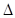 H
H
已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
用△H1、△H2和△H3表示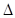 H,则
H,则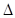 H= ;
H= ;
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式如图)之间脱去两
个水分子产物,其结构式为 ,三聚
磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ;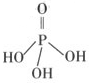
(3)次磷酸钠(NaH2PO2)可用于工业上的化学镀镍。
①化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑ 请在答题卡上写出并配平反应式(a);
请在答题卡上写出并配平反应式(a);
②利用①中反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;
原理上的不同点: ;
化学镀的优点: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com