
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
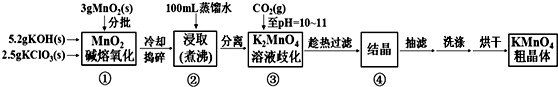
分析 根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体.
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应;
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应;
②当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾;
(3)加热时高锰酸钾会分解生成锰酸钾;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应;用电解法可以将K2MnO4完全转化成KMnO4;
(5)①酸性溶液只能用酸式滴定管量取,碱性溶液只能用碱式滴定管量取;若该滴定管用蒸馏水洗净后未润洗,则最终测定结果将偏小;
②高锰酸根在酸性条件下与草酸反应生成 锰离子和二氧化碳,据此书写离子方程式.
解答 解:根据流程图知,①中发生反应3MnO2+KClO3+6KOH$\frac{\underline{\;熔化\;}}{\;}$3K2MnO4+KCl+3H2O,冷却后捣碎加入蒸馏水并煮沸,然后过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,根据溶解性表知,K2MnO4溶解度最小,趁热过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体,
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,步骤①中含有KOH碱性物质,KOH能和SiO2反应生成硅酸钾,所以应该用铁坩埚熔融,
故选:D;
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,所以不能选取,硫酸酸性太强,可以选取醋酸,故选:B;
②当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低,
故答案为:二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低;
(3)如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低,
故答案为:如果温度过低,烘干时间过长,如果温度过高,高锰酸钾受热分解;
(4)惰性电极作阳极,铁作阴极,则阳极上失去电子发生氧化反应,则阳极反应为MnO42--e-═MnO4-,与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率,
故答案为:MnO42--e-═MnO4-;K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率;
(5)①酸性溶液只能用酸式滴定管量取,碱性溶液只能用碱式滴定管量取,高锰酸钾溶液具有酸性,应该用酸式滴定管量取;
若该滴定管用蒸馏水洗净后未润洗,会稀释溶液浓度,则最终测定结果将偏小,
故答案为:酸式;偏小;
②高锰酸根在酸性条件下与草酸反应生成 锰离子和二氧化碳,反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,
故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
点评 本题考查制备实验方案设计,涉及仪器的选取、物质检验、对操作的分析评价、物质的量的计算、氧化还原反应滴定等知识点,侧重考查学生分析计算、获取信息与迁移运用能力,是对学生综合能力的考查.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中的c(OH-)为1×10-10mol/L | |
| B. | 溶液中的c(H+)为1×10-4mol/L | |
| C. | 溶液中由水电离出来的c(OH-)为1×10-10mol/L | |
| D. | 溶液中由水电离出来的H+的浓度为1×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2P+5O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | B. | Fe2O3+3CO═2Fe+3CO2 | ||
| C. | H2O2$\frac{\underline{\;MnO_2\;}}{\;}$H2↑+O2↑ | D. | NaHCO3+HCl═NaCl+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
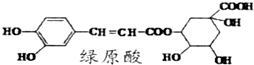
| A. | 分子中所有的碳原子均可能在同一平面内 | |
| B. | 绿原酸可以与FeCl3溶液发生显色反应 | |
| C. | 1 mol绿原酸与足量溴水反应,最多消耗2.5mol Br2 | |
| D. | 绿原酸不能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分属于硅酸盐,硅酸盐与酸、碱都不反应 | |
| B. | 青铜铸造的器皿在空气中易发生析氢腐蚀,铜为原电池负极反应物 | |
| C. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,纤维素与淀粉互为同分异构体 | |
| D. | 黑火药反应:2KNO3+S+3C═K2S+N2+3CO2 的还原剂只有C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
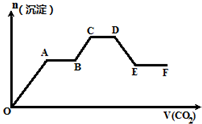 将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示.下列关于整个反应进程中的各种描述不正确的是( )| A. | O~A段反应的离子方程式是Ba2++CO32-═BaCO3↓ | |
| B. | A~B段反应的离子方程式是2OH-+CO2═CO${\;}_{3}^{2-}$+H2O | |
| C. | A~B段与C~D段所发生的反应相同 | |
| D. | D~E段沉淀的减少是由于碳酸钡固体与CO2的水溶液反应所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com