
| A. | 陶瓷的主要成分属于硅酸盐,硅酸盐与酸、碱都不反应 | |
| B. | 青铜铸造的器皿在空气中易发生析氢腐蚀,铜为原电池负极反应物 | |
| C. | 以树皮和麻绳为原料所造的纸张其主要成分是纤维素,纤维素与淀粉互为同分异构体 | |
| D. | 黑火药反应:2KNO3+S+3C═K2S+N2+3CO2 的还原剂只有C |
分析 A.有些硅酸盐与酸要反应,如硅酸钠与盐酸反应生成硅酸和氯化钠;
B.青铜为铜的合金,在空气中发生吸氧腐蚀;
C.分子式相同结构不同的有机物互为同分异构体;
D.含元素化合价升高的物质为还原剂,在反应中被氧化,以此来解答.
解答 解:A.有些硅酸盐与酸要反应,如硅酸钠与盐酸反应生成硅酸和氯化钠,故A错误;
B.青铜为铜的合金,铜不能与氢离子反应,在空气中氧气得电子,发生吸氧腐蚀,故B错误;
C.淀粉和纤维素的表达式虽然相同,但是聚合度n值不同,故分子式不同,二者不互为同分异构体,故C错误;
D.S+2KNO3+3C=K2S+N2↑+3CO2↑中,S、N元素的化合价降低,C元素化合价升高,只有C为还原剂,故D正确;
故选D.
点评 本题考查了常见物质的性质、氧还原反应中还原剂的判断、原电池原理质,熟悉相关物质的性质是解题关键,题目难度不大.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:解答题
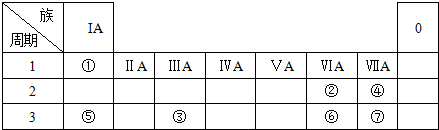
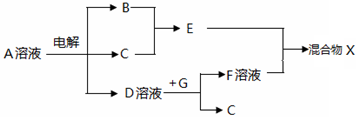
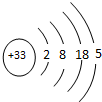 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
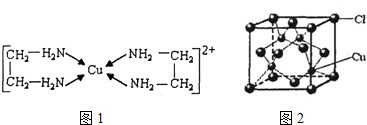
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
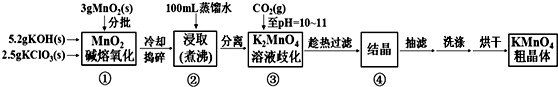
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
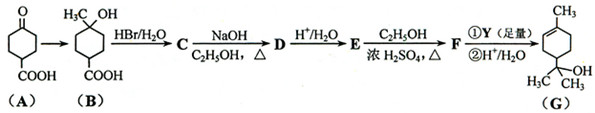
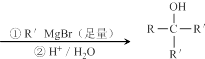
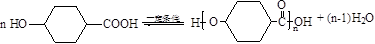 .
.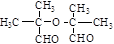 .
.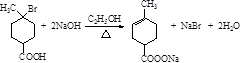 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 3:2:3 | C. | 1:4:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素属于第6周期 | |
| B. | 该元素位于IVA族 | |
| C. | 该元素为金属元素,性质与82Pb(铅)相似 | |
| D. | 该元素原子含有114个电子和184个中子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com