
【题目】已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,C原子的最内电子数是最外层电子数的2倍,D是同周期中单核离子半径最小的元素,E元素的最高正价与最低负价的代数和为6。请回答下列问题:
(1)化合物M的电子式为_________
(2)B、C所形成的简单离子中,半径较大的是________用离子符号表示)。
(3)E的单质与A的简单氧化物反应的离子方程式为________
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为________,每生成1mol气体转移的电子数为_________。
(5)工业上,将CEO3与Na2SO3溶液混合,再加人转H2SO4制备净水剂EO2,则该反应的离子方程式为__________
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为_________
【答案】 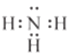 或
或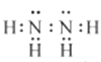 N3- Cl2+H2O=Cl-+HClO+H+ AlH3+3H2O=Al(OH)3+3H2↑ NA (或6.02×1023) 2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)ΔH=-57.3KJ/mol
N3- Cl2+H2O=Cl-+HClO+H+ AlH3+3H2O=Al(OH)3+3H2↑ NA (或6.02×1023) 2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)ΔH=-57.3KJ/mol
【解析】本题主要考查元素周期表和元素周期律。
已知A、B、C、D、E为原子序数依次增大的五种短周期元素,A与B形成的共价化合物M的水溶液呈碱性,M可以是氨,A、B分别是氢、氮。C原子的最内电子数是最外层电子数的2倍,C是钠。D是同周期中单核离子半径最小的元素,D是铝。E元素的最高正价与最低负价的代数和为6,E是氯。
(1)化合物M的电子式为![]() 或
或 。
。
(2)B、C所形成的简单离子的电子层结构相同,离子半径随着核电荷数增大而减小,所以半径较大的是N3-。
(3)E的单质氯气与A的简单氧化物水反应的离子方程式为Cl2+H2O=Cl-+HClO+H+。
(4)A、D形成的化合物DA3与水反应生成无色气体,则该反应的化学方程式为AlH3+3H2O=Al(OH)3+3H2↑,H2~e-,每生成1mol气体转移的电子数为6.02×1023。
(5)工业上,将CEO3与Na2SO3溶液混合,再加人H2SO4制备净水剂EO2,则该反应的离子方程式为2C1O3-+SO32-+2H+=SO42-+2C1O2↑+H2O。
(6)COA的水溶液和AE溶液反应,生成0.5mol水时放出的热量为28.65kJ,则该反应的热化学方程式为NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1) ΔH=-57.3KJ/mol。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】生活因化学更美好。下列说法错误的是
A.氯化铵溶液常用作除锈剂
B.聚乙烯塑料薄膜可用作食品包装袋
C.硫酸钡常用于胃肠X射线造影检查
D.活性炭可用于除去冰箱的异味,此外还具有杀菌作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于水解反应且使溶液显酸性的是( )
A.NH4++H2ONH3H2O+H+
B.HCO3﹣+H2OCO32﹣+H3O+
C.S2﹣+H2OHS﹣+OH﹣
D.NH3+H2ONH4++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨是含硫氧化物或含氮氧化物随雨写降到地面形成的,主要由化石燃料的大量使用造成,酸雨的治理响应了十九大报告提出的保护环境的基本国策。
(1)煤燃烧烟尘中的锰、铁等可使SO2转化为SO3发生反应2SO2(g)+O2(g)=2SO3(g)。某温度下将2.0molSO2和1.0molO2充入2L密闭容器中,若反应达平衡后,SO2的平衡转化率为0.6,则该反应的平衡常数为______。若升高温度,平衡常数减小,则该反应的ΔH_______0(填“>”、“=”“<”)。
(2)高浓度SO2和NO2在浓雾天气下反应生成了两种物质,其中一种为亚硝酸(HNO2),该过程发生反应的化学方程式为_________。
(3)洗涤含SO2的烟气,可以减少SO2排放,以下物质的溶液可作洗涤剂的是______。
a.氨气 b.苏打 c.氨水 d.明矾
(4)汽车尾气中含有NOx和CO,已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g),则在恒容密闭容器中,下列说法中能说明该反应达到平衡状态的是________。
2NO(g),则在恒容密闭容器中,下列说法中能说明该反应达到平衡状态的是________。
a.混合气体的压强保持不变
b.混合气体的平均相对分子质量保持不变
c.NO质量分数保持不变
d.氧气的浓度保持不变
e.N2和NO正反应速率之比为1:2
(5)SO2可以变废为宝,利学家研究出了用电化学原理生产硫酸的新工艺(如下图所示),其阳极的电极反应式为__________。
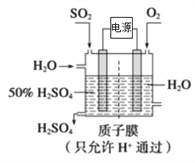
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲分离苯和苯酚,一般可向其混合物中加入稍过量的浓氢氧化钠溶液,反应的离子方程式为____;再将该混合物转移到分液漏斗中,振荡,静置后溶液将出现分层现象,然后分液.从分液漏斗放出下层液体,加入适量盐酸,再将其分成两份:向一份溶液中加入三氯化铁溶液,出现的现象是________;向另一份溶液中加入浓溴水,发生反应的化学方程式是_____.从分液漏斗上口倒出的上层液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL 浓度均为0.1000mol/L 的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是
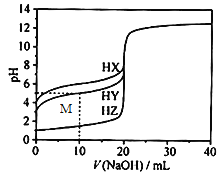
A. 该滴定过程能选择酚酞作为指示剂
B. HZ是强酸
C. HX消耗NaOH溶液20.00mL时,溶液pH>7
D. M 点处的溶液中c(Na+)>c(Y-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com