
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
分析 根据电池反应可知,放电时LiFePO4电池负极反应为Li-e-═Li+,正极反应为FePO4+Li++e-═LiFePO4;充电时的阳极反应和原电池中正极反应相反,阴极反应和原电池中负极反应相反,根据原电池和电解池的工作原理来回答.
解答 解:A、金属锂可以和硫酸发生化学反应,所以不能加入硫酸以提高电解质的导电性,故A错误;
B、放电时,是原电池的工作原理,原电池中,阳离子移向正极,故B错误;
C、放电时,Li发生氧化反应,故C错误;
D、放电时,是原电池的工作原理,正极反应为:FePO4+Li++e-═LiFePO4;故D正确;
故选D.
点评 本题考查化学电源新型电池知识,本题难度不大,注意根据电池反应书写电极反应式的方法,以及离子的定向移动问题.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
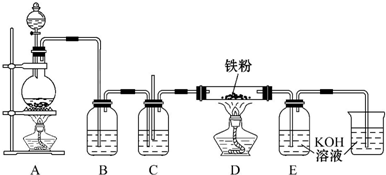
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 微粒组 | 所加试剂 | 离子方程式 |
| A | NH4+、Mg2+、SO42- | 少量Ba(OH)2溶液 | NH4++SO42-+Ba2++OH-=BaSO4↓+NH3•H2O |
| B | Mg2+、HCO3-、Cl- | 过量NaOH溶液 | Mg2++2HCO3-+2OH-=MgCO3-↓+CO32-+2H2O |
| C | H+、Na+、NO3- | Fe粉 | Fe+2H+=Fe2++H2↑ |
| D | Ca2+、NH3•H2O、Cl- | 通入过量CO2 | NH3•H2O+CO2=NH4++HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
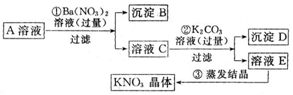
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑦ | B. | 除⑤⑥外 | C. | ②③⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
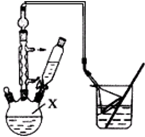 对叔丁基苯酚(
对叔丁基苯酚(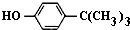 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com