
 对叔丁基苯酚(
对叔丁基苯酚(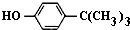 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚. .
.分析 (1)根据实验装置图可知仪器名称;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,据此写方程式;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚易溶于酒精;
(4)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏;
(5)根据反应 可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
可计算出对叔丁基苯酚的理论产量,再根据产率=$\frac{实际产量}{理论产量}$×100%计算.
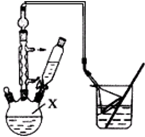
解答 解:(1)根据实验装置图可知仪器X为三颈(口)烧瓶,
故答案为:三颈烧瓶;
(2)该反应是苯酚、叔丁基氯生成产品的反应,从结构上分析为取代反应,反应方程式为 ,
,
故答案为: ;
;
(3)反应产生极易溶解于水的HCl,且反应温度较高,故用倒扣的漏斗防止倒吸;苯酚以溶于酒精,所以苯酚沾到皮肤上可用酒精洗涤,
故答案为:防止倒吸;酒精;
(4)根据仪器使用规则,容量瓶、滴定管、分液漏斗在使用前都必须检漏,故选BCD;
故答案为:BCD;
(5)根据反应:
94 150
1.6g x
x=$\frac{1.6×150}{94}$=2.55g,
则对叔丁基苯酚的产率为$\frac{1.8g}{2.55g}$×100%=70.6%;
故答案为:70.5%.
点评 本题有机物的合成为载体,考查化学实验,题目综合性较大,涉及对实验原理的理解、对装置的分析评价、对实验条件的选择控制、实验方案设计、物质分离提纯、化学计算等,难度中等,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
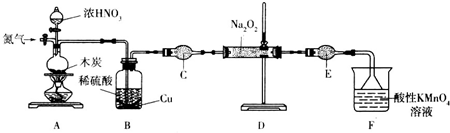
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
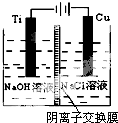 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; |
| 方法c | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 序号 | 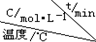 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测HCl溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com