
����Ŀ����1.0L�ܱ������з���0.10mol A��g������һ���¶Ƚ������·�Ӧ��A��g���TB��g��+C��g����H=+85.1kJmol��1��Ӧʱ�䣨t����������������ѹǿ��p�������ݼ�����
ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
�ش��������⣺
��1�������A��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ��д�������ʩ����
��2������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽΪ �� ƽ��ʱA��ת����Ϊ �� ��ʽ�����㷴Ӧ��ƽ�ⳣ��K ��
��3������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A����n���ܣ�=mol��n��A��=mol��
���𰸡�
��1�������¶ȡ�����ѹǿ
��2���� ![]() ��1����100%��94.1%��1.5mol/L
��1����100%��94.1%��1.5mol/L
��3��![]() ��0.10����2��
��0.10����2�� ![]() ��
��
���������⣺��1����һ���¶Ƚ������·�Ӧ��A��g��B��g��+C��g ����H=+85.1kJmol��1��Ӧ�����ȷ�Ӧ����Ӧǰ���������������ƽ���ƶ�ԭ��������֪�������A��ƽ��ת���ʣ�ƽ��������У��������»��ѹ������ʹƽ��������У�
�ʴ𰸣������¶ȡ�����ѹǿ����2����Ӧǰ���������ʵ�������Ϊ��Ӧ��A��������������ѹǿp����ʼѹǿp0���㷴Ӧ��A��ת���ʦ���A���ı���ʽ= ![]() ��100%=��
��100%=��![]() ��1����100%��
��1����100%��
ƽ��ʱA��ת����= ![]() ��100%=94.1%��
��100%=94.1%��
A��g�� | B��g��+ | C��g �� | ||
��ʼ����mol/L�� | 0.10 | 0 | 0 | |
�仯����mol/L�� | 0.10��94.1% | 0.10��94.1% | 0.10��94.1% | |
ƽ������mol/L�� | 0.10��1��94.1%�� | 0.10��94.1% | 0.10��94.1% |
K= ![]() =
= ![]() =1.5mol/L
=1.5mol/L
���Դ��ǣ��� ![]() ��1����100%��94.1%��1.5mol/L����3��������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A��������ѹǿ֮�ȵ������ʵ���֮�ȣ�n����n��ʼ=P��P0 �� n��=
��1����100%��94.1%��1.5mol/L����3��������ѹǿp����ʼѹǿp0��ʾ��Ӧ��ϵ�������ʵ���n���ͷ�Ӧ��A�����ʵ���n��A��������ѹǿ֮�ȵ������ʵ���֮�ȣ�n����n��ʼ=P��P0 �� n��= ![]() ��
��
A��g�� | B��g��+ | C��g �� | ||
��ʼ����mol/L�� | 0.10 | 0 | 0 | |
�仯����mol/L�� | x | x | x | |
ƽ������mol/L�� | 0.10- x | x | x |
��0.10+x����0.10=P��P0
x= ![]() ��
��
n��A��=0.10�� ![]() =0.10����2��
=0.10����2�� ![]() ��mol��
��mol��
���Դ��ǣ� ![]() ��0.10����2��
��0.10����2�� ![]() ����
����
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±������ķ���ʽ���й��ɣ��жϿո��е�����ͬ���칹����Ŀ�� ��
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.2
B.3
C.4
D.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������о������ʣ���H2 ���� ��CuO ��CO2��H2SO4 ��Ba��OH��2����߰�ˮ ��ϡ���� ������Al2��SO4��3
��1������״̬�¿ɵ��������
���ڵ���ʵ�����
���ڷǵ���ʵ��� ��
��2��������������������������֮��ɷ������ӷ�Ӧ��H++OH���TH2O�������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪ ��
��3������ˮ�еĵ��뷽��ʽΪ �� 34.2g ������ˮ���250mL��Һ��SO42�������ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ��Ksp��AgCl����1.8��10-10��Ksp��AgBr����5.0��10-13�����¶��£�����˵���������
A. AgCl������Һ��ͨ������HCl��c��Ag+����С
B. AgCl��AgBr���������Һ�У�c��Cl-��/c��Br-��=360
C. AgBr����Һ�м�������NaCl������AgCl��������
D. ��Ũ�ȵ�NaCl��NaBr�����Һ�еμ�AgNO3��Һ��������AgCl����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��ı䷴Ӧ����n(SO2���Է�Ӧ2SO2��g��+O2��g��![]() 2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ����
2SO3��g����H<0��Ӱ����ͼ��ʾ������˵����ȷ����
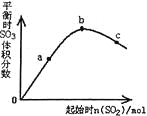
A. ��Ӧb��c���Ϊƽ��㣬a��δ��ƽ����������Ӧ�������
B. a��b��c�����ƽ�ⳣ��Kb>Kc>Ka
C. ����ͼ����Եó�SO2�ĺ���Խ�ߵõ��Ļ��������SO3���������Խ��
D. a��b��c�����У�a��ʱSO2��ת�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������ʾ��ͼ�β�һ�µ���

A. ͼ����ʾ25��ʱ����0.1 mol��L��1����ζ�20 mL 0.1 mol��L��1NaOH��Һ����ҺpH���������ı仯
B. ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)![]() 2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C. ͼ����ʾ10 mL 0.01 mol��L��1KMnO4������Һ�����0.1 mol��L��1������Һ��ϣ�n(Mn2+) ��ʱ��ı仯
D. ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2(g)+ H2(g) ��CH3CH3(g)����H>0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ���������ʣ������й��Լ��Ͳ�����������ȷ���ǣ� ��
A.�������ӣ���ϡNaOH��Һ����Һ
B.�Ҵ������ᣩ��KOH��Һ����Һ
C.���飨��ϩ������ˮ��ϴ��
D.�����壩��ϡNaOH��Һ����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���顣
���Լ��顢����������������ҺΪԭ�ϣ�ʯīΪ�缫�ɹ���ȼ�ϵ�ء��õ�صĸ�����ӦʽΪ___________________________��
�ڽ�������ȵ�������ʯī���ֱ����CuCl2��Һ�У������Ӽ���ȼ�ϵ�ظ�����ʯī���Ӹõ��������һ��ʱ�����������ʯī��������6.4�ˡ�д�������缫�Ϸ����ĵ缫��Ӧʽ________��������������CH4������ڱ�״����Ϊ_____��
��2����ͼ��ʾ��ʵ��װ���У���Ϊ�õ⻯����Һ��ʪ����ֽ��m��nΪ������ֽ���˵IJ��У���Ϊֱ����Դ��x��yΪ��Դ��������GΪ�����ƣ�A��B��C��D�ĸ��缫��Ϊʯī�缫���������Թ��г���H2SO4��Һ������H2SO4��Һ��ˮ���У��պ�K2���Ͽ�K1��

�ٱ����ʱ��Ӧ�����ӷ���ʽΪ______________��
�ڼ������һ��ʱ��׳���A��B�������ֱ������Χ����ʱ�Ͽ�K2���պ�K1��������Gָ�뷢��ƫת����B���ĵ缫��ӦʽΪ__________________��C���ĵ缫��ӦΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ����������ʱ�������ܹ۲쵽�����ЧӦ���ǣ� ��
A.ϡ����
B.NaCl��Һ
C.Fe��OH��3����
D.H2SiO3����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com