
【题目】根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.2
B.3
C.4
D.5
科目:高中化学 来源: 题型:
【题目】Ⅰ.硫在地壳中主要以硫化物、硫酸盐等形式存在,其单质和化合物在工农业生产中有着重要的应用。
(1)利用下图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
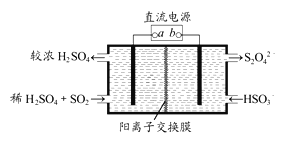
①阳极的电极反应式为__________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为_________。
Ⅱ.乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
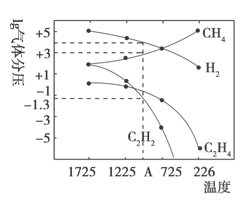
(2)T2℃时,向1L恒容密闭容器中充入0.3molCH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
C2H4(g)+2H2(g) ΔH,达到平衡时,测得c(C2H4)= c(CH4)。该反应的ΔH____0(填“>”或“<”),CH4的平衡转化率为_________。上述平衡状态某一时刻,若改变温度至T℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时2c(C2H4) = c(CH4),则t=________s。
(3)列式计算反应2CH4(g) =C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=_________(用平衡分压代替平衡浓度计算:lg![]() ≈ -1.3)。
≈ -1.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.淀粉、纤维素、油脂均属于高分子化合物
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.蛋白质水解的最终产物是多肽
D.石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.天然油脂的主要成分是高级脂肪酸
B.分馏、干馏都是物理变化,裂化、裂解都是化学变化
C.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
D.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.蔗糖、果糖和麦芽糖均为双糖
B.绝大多数酶是一类具有高选择催化性能的蛋白质
C.植物油含不饱和脂肪酸酯,能使溴的四氯化碳溶液褪色
D.淀粉和纤维素水解的最终产物均为葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的是 ( )
A. (3m+n)mol B. ![]() C. (3m+n+2p)mol D.
C. (3m+n+2p)mol D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1.0L密闭容器中放入0.10mol A(g),在一定温度进行如下反应:A(g)═B(g)+C(g)△H=+85.1kJmol﹣1反应时间(t)与容器内气体总压强(p)的数据见表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为(写出两项措施).
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为 . 平衡时A的转化率为 , 列式并计算反应的平衡常数K .
(3)由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=mol,n(A)=mol.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com