
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的是 ( )
A. (3m+n)mol B. ![]() C. (3m+n+2p)mol D.
C. (3m+n+2p)mol D. ![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.反应中化合价降低的物质是还原剂
B.有氧元素参加的反应一定是氧化还原反应
C.反应前后元素化合价没有变化的反应一定不是氧化还原反应
D.氧化剂在反应中被氧化,还原剂在反应中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中烃的分子式排列规律,判断空格中的烃的同分异构体数目( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
A.2
B.3
C.4
D.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是______(答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极反应式______。
xNiOOH+MHx,试写出放电过程中负极反应式______。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O == BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为______,用离子方程式表示溶液显碱性的原因______。
(4)在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入a g的储氢合金(M)和b mol H2发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
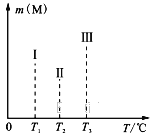
(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢:![]() 。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③CuO ④CO2⑤H2SO4 ⑥Ba(OH)2固体⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)上述状态下可导电的是;
属于电解质的是;
属于非电解质的是 .
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH﹣═H2O,该离子反应对应的化学方程式为 .
(3)⑨在水中的电离方程式为 , 34.2g ⑨溶于水配成250mL溶液,SO42﹣的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13。该温度下,下列说法错误的是
A. AgCl的悬浊液中通入少量HCl,c(Ag+)减小
B. AgCl和AgBr共存的悬浊液中,c(Cl-)/c(Br-)=360
C. AgBr悬浊液中加入足量NaCl可能有AgCl沉淀生成
D. 等浓度的NaCl和NaBr混合溶液中滴加AgNO3溶液,先析出AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
①以甲烷、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池的负极反应式为___________________________。
②将质量相等的铁棒和石墨棒分别插入CuCl2溶液中,铁棒接甲烷燃料电池负极,石墨棒接该电池正极,一段时间后测得铁棒比石墨棒增加了6.4克。写出铁棒电极上发生的电极反应式________;则理论上消耗CH4的体积在标准状况下为_____。
(2)如图所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极。若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1。

①丙电解时反应的离子方程式为______________。
②继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为__________________,C极的电极反应为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com