
【题目】氢能被视为21世纪最具发展潜力的清洁能源,其开发利用是科学家们研究的重要课题。试回答下列问题:
(1)与化石燃料相比,氢气作为燃料的优点是______(答出两点)。
(2)与氢气直接燃烧相比较,设计成镍氢电池可以大大提高能量的转换率,在镍氢电池充电过程中储氢合金(M)吸氢转化为MH2,总反应为:xNi(OH)2+M![]() xNiOOH+MHx,试写出放电过程中负极反应式______。
xNiOOH+MHx,试写出放电过程中负极反应式______。
(3)施莱辛(Sehlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O == BO2-+4H2↑,已知NaBH4与水反应后所得溶液显碱性,溶液中各离子浓度大小关系为______,用离子方程式表示溶液显碱性的原因______。
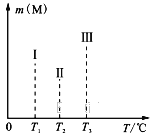
(4)在容积均为V L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中,分别放入a g的储氢合金(M)和b mol H2发生如下反应:2M(s)+xH2(g)![]() 2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
2MHx(s) ΔH<0。三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到1min时M的质量如下图所示,此时Ⅰ、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是______。当三个容器反应都达到化学平衡时,H2转化率最大的反应温度是____。
(5)储氢还可以借助有机物,如利用乙苯与苯乙烯之间的可逆反应来实现脱氢和加氢:![]() 。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
。维持体系总压恒定,在温度T时,物质的量为n、体积为V的乙苯蒸气发生催化脱氢。已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=_____(用α等符号表示)。
【答案】 原料来源广、燃烧热值高、污染小、可再生等(或其他合理答案给分) MHx +xOH--xe-=== M+xH2O c(Na+)>c(BO2-)>c(OH-)>c(H+) BO2-+2H2 O![]() H3BO3+OH- Ⅲ T1 nα2/ [(1-α2)V ]
H3BO3+OH- Ⅲ T1 nα2/ [(1-α2)V ]
【解析】试题分析:(1)氢气可以从水中获得,氢气燃烧的产物是水,无污染;(2)放电时负极失电子发生氧化反应; NaBH4与水反应后所得溶液是NaBO2,溶液显碱性说明NaBO2是强碱弱酸盐, BO2-水解;(4)温度越高反应速率越快, ![]() , T3时M的物质的量大于T2;ΔH<0升高温度平衡逆向移动;(5)平衡常数K=
, T3时M的物质的量大于T2;ΔH<0升高温度平衡逆向移动;(5)平衡常数K=![]() ;
;
解析:(1)氢气作为燃料的优点是原料来源广、燃烧热值高、污染小;(2)放电时负极失电子发生氧化反应,负极反应式是MHx +xOH--xe-=== M+xH2O; NaBH4与水反应后所得溶液是NaBO2,溶液显碱性说明NaBO2是强碱弱酸盐, BO2-水解,所以离子浓度大小关系是c(Na+)>c(BO2-)>c(OH-)>c(H+),BO2-水解的离子方程式是BO2-+2H2 O![]() H3BO3+OH-;(4)温度越高反应速率越快,
H3BO3+OH-;(4)温度越高反应速率越快, ![]() , T3时M的物质的量大于T2,所以Ⅲ容器一定达到平衡状态;ΔH<0升高温度平衡逆向移动,都达到化学平衡时,H2转化率最大的反应温度是T1;(5)平衡时,乙苯的物质的量浓度是
, T3时M的物质的量大于T2,所以Ⅲ容器一定达到平衡状态;ΔH<0升高温度平衡逆向移动,都达到化学平衡时,H2转化率最大的反应温度是T1;(5)平衡时,乙苯的物质的量浓度是![]() 、苯乙烯的物质的量浓度是
、苯乙烯的物质的量浓度是![]() 、氢气的浓度是
、氢气的浓度是![]() ,平衡常数K=
,平衡常数K=![]() =
= = nα2/ [(1-α2)V ];
= nα2/ [(1-α2)V ];


科目:高中化学 来源: 题型:
【题目】下列与有机物的结构、性质的有关叙述中正确的是( )
A.天然油脂的主要成分是高级脂肪酸
B.分馏、干馏都是物理变化,裂化、裂解都是化学变化
C.乙烯、氯乙烯、聚乙烯均可使酸性高锰酸钾溶液褪色
D.乙酸与乙醇可以发生酯化反应,又均可与金属钠发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时在10mL 0.1molL﹣1Na2CO3溶液中逐滴加入0.1molL﹣1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( ) 
A.Na2CO3溶液中c(Na+)═2[c(CO32﹣)+c(HCO3﹣)+c(H2CO3)]
B.a、b曲线分别代表的是HCO3﹣、H2CO3量的变化情况
C.A点时:c(Na+)>c(CO32﹣)═c(HCO3﹣)>c(H+)>c(OH﹣)
D.B点时加入盐酸的体积为10mL,两者恰好完全反应生成NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】m mol C2H2跟n mol H2在密闭容器中反应,当该可逆反应达到平衡时,生成p mol C2H4。将反应后的混合气体完全燃烧,生成CO2和H2O,所需要氧气的物质的是 ( )
A. (3m+n)mol B. ![]() C. (3m+n+2p)mol D.
C. (3m+n+2p)mol D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
A.1:1B.1:2C.1: 3D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
(1)画出示意图并标出原电池的正、负极和电子的流向(画在下面方框中) , 供选用的电解质溶液有:稀硫酸、硫酸铜溶液、三氯化铁溶液.
供选用的电极材料有:锌片、铜片、铁片、石墨.
(2)写出电极反应式. 电极材料及电极反应式:
负极材料: ,
电极反应式:
正极材料: ,
电极反应式:
电解质溶液:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com