
����Ŀ��X��Y��Z��W��ԭ��������������IJ�ͬ����Ķ�����Ԫ�ء�X���������������۴�����Ϊ0��YΪ����Ԫ�أ�Y��Z����������֮����W��������������ȣ�X��W����������֮�͵���10������˵����ȷ����
A.���⻯������ȶ��ԣ�Z��W��X
B.Z��W�ļ���̬�⻯������ԭ�ӵ��ӻ���ʽ����ͬ
C.XW2���ӵĿռ乹��Ϊֱ����
D.Z����ۺ������������Һ�������ֺ�ZԪ�ص���
���𰸡�C
��������
������Ԫ��X��Y��Z��W��ԭ�����������������Ƿֱ�λ�ڲ�ͬ�����壬X���������������۴�����Ϊ0��X��W����������֮�͵���10����X���ڢ�A���壬W���ڢ�A�壬���ԭ��������֪��XΪCԪ�ء�WΪSԪ�أ�Y��Z����������֮����W����ȣ�����������������֮��Ϊ6�������ڷֱ�λ�ڲ�ͬ�����壬ֻ��ΪIA����A��Ԫ�أ����ԭ����������YΪNa��ZΪPԪ�أ��ݴ˷������Ԫ�����ʽ��
A��XΪCԪ�ء�WΪSԪ�أ�ZΪPԪ�أ��ǽ�����Խǿ�������̬�⻯����ȶ���Խǿ���ǽ�����W��Z�����⻯������ȶ��ԣ�W��Z����A����
B��WΪSԪ�أ�ZΪPԪ�أ�Z��W�ļ���̬�⻯��ֱ�ΪPH3��H2S��PH3����ԭ��P�ļ۲���Ӷ���=3+![]() =4��Pԭ�ӵ��ӻ���ʽΪsp3�ӻ���H2S����ԭ��S�ļ۲���Ӷ���=2+
=4��Pԭ�ӵ��ӻ���ʽΪsp3�ӻ���H2S����ԭ��S�ļ۲���Ӷ���=2+![]() =4��Sԭ�ӵ��ӻ���ʽΪsp3�ӻ�����������ԭ�ӵ��ӻ���ʽ��ͬ����B����
=4��Sԭ�ӵ��ӻ���ʽΪsp3�ӻ�����������ԭ�ӵ��ӻ���ʽ��ͬ����B����
C��XΪCԪ�ء�WΪSԪ�أ�XW2ΪCS2��CS2��CO2��Ϊ�ȵ����壬��Ϊ�ȵ�����ķ��Ӿ������ƵĽṹ��CO2���ӵĿռ乹��Ϊֱ���ͣ���CS2���ӵĿռ乹��ҲΪֱ���ͣ���C��ȷ��
D��ZΪPԪ�أ�Z����ۺ������������ҺΪNa3PO4��Na3PO4����ǿ�������Σ�PO43-����Һ�з����ಽˮ�⣬����Һ����PO43-��HPO42-��H2PO4-��H3PO4���ֺ�PԪ�ص������ڣ���D����
��ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���һˮ�ϰ�����Ҫ���������������£�����볣�����±���ʾ���ش��������⣺
������� | H2CO3 | NH3��H2O | |
���볣�� |
|
|
|
(1)̼���һ�����뷽��ʽΪ______���������볣������ʽ![]() ________��
________��
(2)Ũ�Ⱦ�Ϊ0.01 mol.L-1��H2CO3��Һ��NH3��H2O��Һ�������ϣ������Һ�е�������_______(д��ѧʽ)�������Һ��![]() ��
��![]() ��
��![]() ��
��![]() ��Ũ���ɴ�С��˳����_______��
��Ũ���ɴ�С��˳����_______��
(3)![]() ��
��![]() ��ˮ��Һ����ٽ�ˮ�⣬��ӦΪ
��ˮ��Һ����ٽ�ˮ�⣬��ӦΪ![]() �������£��÷�Ӧ��ƽ�ⳣ��
�������£��÷�Ӧ��ƽ�ⳣ��![]() _______��(����2λ��Ч����)��
_______��(����2λ��Ч����)��
(4)�����£���100 mL 0.2 mol.L-1NaHCO3��Һ�м���100 mL 0.2 mol��L-1NH3��H2O��Һ����![]() +____+_____��
+____+_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���һ��ʵ����ͼ��ʾ������ת����ϵ����

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����У���ʹ����ƽ��H2O![]() H+ + OH�������ƶ�����Һ�����Ե���( )
H+ + OH�������ƶ�����Һ�����Ե���( )
A. ��ˮ�м���NaHSO4��Һ B. ��ˮ�м���Al2(SO4)3��Һ
C. ��ˮ�м���Na2CO3��Һ D. ��ˮ���ȵ�100�棬ʹˮ��pH=6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֲ�����ᷢչ��Ӧ�ù㷺��Ϊ�о�ij��̼�ظ�(������̼����)�ijɷ֣�����С�����������̽�������ȡ̼�ظ�(�ѳ�����������)97.50 g�������·�Ӧ������O2��Ӧ����ȥδ��Ӧ��O2���ռ�������������X 1.12 L(������ɱ�״���µ����)��
(1)̼�ظ�����___________����(����)
A���л��߷��Ӳ��� B���������� C�����ǽ������� D�����ϲ���
(2)����С������ͼ��ʾʵ��װ�ü���������X����ɡ�
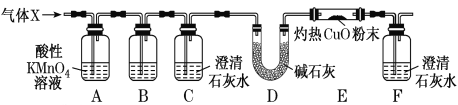
��װ��B�е��Լ���______________��װ��C��������______________��
�����۲쵽_________________(��ʵ������)��֤��X�к���CO��
(3)��Ӧ�����·�Ӧ���ڹ����г�����Fe3��֮�⣬�����ܺ���Fe2����Ҫȷ�����е�Fe2������ѡ��________(�����)��
a��ϡH2SO4��KMnO4��Һ b��KSCN��Һ������
c��ϡ�����K3[Fe(CN)6]��Һ d��KSCN��Һ����ˮ
(4)����С������ͼ��ʾװ��(����)�ⶨSO2�����������������̼�ظֵĺ�̼����������X ����ͨ��ʵ��װ�ã����۲쵽___________________(��ʵ������)ʱ��ֹͣͨ������ʱ������������ʾ������Ϊ224 mL(�ѻ���ɱ�״���µ����)��װ�â��еĻ�ѧ��Ӧ����ʽΪ________________��̼�ظ���̼Ԫ�ص���������Ϊ_________(����1λС��)��
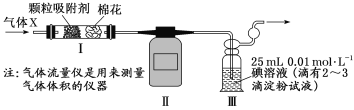
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ�һ����ȡCu2O�ĵ���ʾ��ͼ���£�����ܷ�ӦΪ2Cu��H2O![]() Cu2O��H2��������˵����ȷ����
Cu2O��H2��������˵����ȷ����
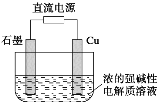
A.ʯī�缫�ϲ�������
B.ͭ�缫������ԭ��Ӧ
C.ͭ�缫��ֱ����Դ�ĸ���
D.����0.1mol����ת��ʱ����0.1mol Cu2O����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�еĻ�ѧ��Ӧ��������ӷ�Ӧ������Ҫ��ش��������⣺
��1���μ�أ����϶�Na2CO3��NaCl��������ֲ�����������û�ѧ����ʽ��ʾ���μ�ز������Ե�ԭ��___��ũҵ����ʯ�ཱུ������Եķ�Ӧԭ����___��
��2����ȡpH���������ȵ�NaOH��Һ�Ͱ�ˮ�ֱ���ˮϡ��m����n����ϡ�ͺ�pH����ȣ���m__n������>����<������=����
��3�������£���pH=6��CH3COOH��CH3COONa�Ļ����Һ��ˮ���������c(OH-)=__��
��4��25��ʱ����amol/L��ˮ��0.01mol/L����������ϣ���Ӧƽ��ʱ��Һ��c(NH![]() )=c(Cl-)������Һ��__���������������������������ԡ�
)=c(Cl-)������Һ��__���������������������������ԡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ũ���ص�װ����ͼ��ʾ����Һ���м����ʯ����Һ[��Ҫ�ɷ�ΪCa(OH)2]����Һ��ͨ��CO2(��NaClΪ֧�ֵ����)���������ܵ�ͬʱ��������������ʡ����������������
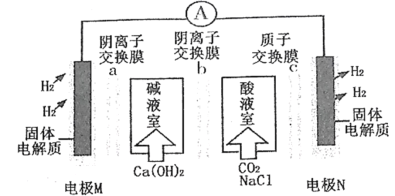
A.�����ɵ缫M�����·����缫N
B.�ڼ�Һ�ҿ�������NaHCO3��Na2CO3
C.�ŵ�һ��ʱ�����Һ����ҺpH��С����Һ��pH����
D.Cl-ͨ�������ӽ���Ĥb�����Һ�ң�H��ͨ�����ӽ���Ĥc����N��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ϊ1mL��Ũ�Ⱦ�Ϊ0.10mol/L��XOH��X2CO3��Һ�ֱ��ˮϡ�������ΪVmL��pH��lgV�ı仯�����ͼ��ʾ��������������ȷ���ǣ� ��
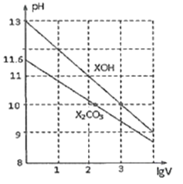
A.VOH����
B.pH=10��������Һ�е�c(X+)��XOH����X2CO3
C.��lgV=3ʱ��XOH��Һ����ˮ�����OH-��Ũ��Ϊ10-10mol/L
D.��lgV=2ʱ����X2CO3��Һ�����¶ȣ���Һ������ǿ��![]() ��С
��С
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com