
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:___;农业上用石膏降低其碱性的反应原理:___;
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m__n(填“>”“<”或“=”)
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__;
(4)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。
)=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。
【答案】![]()
![]() < 108mol/L 中
< 108mol/L 中
【解析】
(1)盐碱地产生碱性的原因是碳酸钠水解,据此写化学方程式即可;用石膏降低其碱性的反应原理从石膏和纯碱反应的角度回答;
(2)若pH、体积均相等的NaOH溶液和氨水稀释相同倍数,则所得稀溶液的pH是氨水的大,因为加水促进了一水合氨的电离,据此可推算分别用水稀释m倍、n倍,稀释后pH仍相等时m<n;
(3)常温下,若CH3COOH与CH3COONa的混合溶液pH=6,即呈酸性,则可知醋酸电离为主,则水的电离被抑制,水电离出来的c(OH-)<107mol/L,可以按水的离子积常数及氢离子浓度计算所得;
(4)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中![]() ,结合电荷守恒式可以计算氢离子浓度和氢氧根浓度的相对大小,从而判断溶液显的酸碱性;
,结合电荷守恒式可以计算氢离子浓度和氢氧根浓度的相对大小,从而判断溶液显的酸碱性;
(1)碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,化学方程式为![]() ;石膏主要成分是CaSO4,Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,其溶液呈中性,所以石膏能降低其碱性,反应方程式为
;石膏主要成分是CaSO4,Na2CO3、CaSO4反应生成难溶性的碳酸钙,同时生成强酸强碱盐硫酸钠,其溶液呈中性,所以石膏能降低其碱性,反应方程式为![]() ;
;
答案为:![]() ;
;![]() ;
;
(2)一水合氨是弱电解质,加水稀释促进一水合氨电离,NaOH是强电解质,完全电离,要使pH相等的氨水和NaOH溶液稀释后pH仍然相等,则氨水稀释倍数大于NaOH,即m<n;
答案为:<;
(3)常温下,pH=6的CH3COOH与CH3COONa的混合溶液呈酸性,说明醋酸电离程度大于醋酸根离子水解程度,该溶液中水的电离被抑制了,则混合溶液中水电离出来的![]() ;
;
答案为:108mol/L;
(4)在25℃下,氨水与盐酸等体积混合,反应平衡时,溶液中c(NH![]() )=c(Cl-),又根据电荷守恒关系有
)=c(Cl-),又根据电荷守恒关系有![]() ,故有
,故有![]() ,所以溶液显中性;
,所以溶液显中性;
答案为:中。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的说法正确的是
A.甲醇在铜催化和加热条件下生成的产物不存在同分异构体
B.2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热,得到三种烯烃。
C.有机物![]() 的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
的同分异构体中,其中属于酯且苯环上有2个取代基的同分异构体有2种。
D.分子式为C5H10O2的有机物中含有![]() 结构的同分异构体有12种
结构的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2![]() +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+![]() +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()
A.O2和![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol![]() 转移2mol电子
转移2mol电子
D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的不同主族的短周期元素。X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10。下列说法正确的是
A.简单氢化物的热稳定性:Z>W>X
B.Z、W的简单气态氢化物中心原子的杂化方式不相同
C.XW2分子的空间构型为直线型
D.Z的最高价含氧酸的钠盐溶液中有三种含Z元素的微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是用途最广的金属材料之一,但生铁易生锈。请讨论电化学实验中有关铁的性质。
(1)①某原电池装置如图所示,右侧烧杯中的电极反应式为__,左侧烧杯中的c(Cl-)__(填“增大”、“减小”或“不变”)。
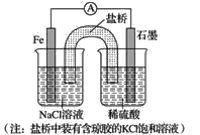
②已知如图甲、乙两池的总反应式均为Fe+H2SO4=FeSO4+H2↑,且在同侧电极(指均在“左电极”或“右电极”)产生H2。请在两池上标出电极材料_____(填“Fe”或“C”)。
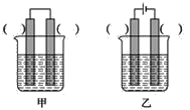
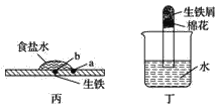
(2)装置丙中,易生锈的是__(填“a”或“b”)点。装置丁中可观察到的实验现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家有色金属工业“十三五”发展规划要求,再生铅占铅总量比重到2020年升至45%。从废旧铅蓄电池中回收的工艺流程为![]() ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是
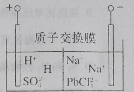
A.电解过程中阳极附近pH明显增大
B.阴极电极反应式为![]() +2e-=Pb+4Cl-
+2e-=Pb+4Cl-
C.电路中通过2 mol电子,阴极可得207 g铅
D.Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
A.2mol85%B.1mol42.5%C.2mol15%D.1mol30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
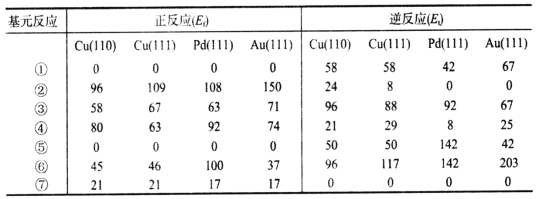
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
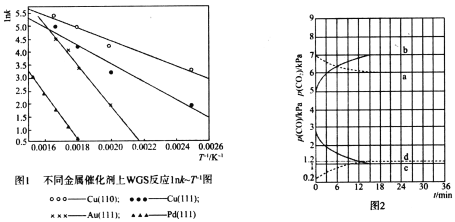
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
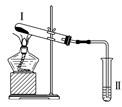
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com