
【题目】水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2![]() +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+![]() +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()
A.O2和![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol![]() 转移2mol电子
转移2mol电子
D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
【答案】D
【解析】
在3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→![]() ;硫元素的化合价变化为:+2→+2.5;氧元素的化合价变化:0→-2,据此解答。
;硫元素的化合价变化为:+2→+2.5;氧元素的化合价变化:0→-2,据此解答。
A.化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→![]() ;硫元素的化合价变化为:+2→+2.5;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-,故A错误;
;硫元素的化合价变化为:+2→+2.5;氧元素的化合价变化:0→-2,所以氧化剂是O2;还原剂是Fe2+、S2O32-,故A错误;
B.由上述分析可知,氧化剂是O2,还原剂是Fe2+、S2O32-,3molFe2+参加反应时只有2mol被氧化,参加反应的氧化剂与还原剂的物质的最之比为1:(2+2)=1:4,故B错误;
C.由方程式可知,每生成1molFe3O4,参加反应的氧气为1mol,转移电子为1mol×4=4mol,故C错误;
D.2molFe2+被氧化时,失去电子2mol,则被Fe2+还原的O2的物质的量为2mol÷4=0.5mol,故D正确;
答案选D。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
C.苯与浓溴水反应制取溴苯
D.![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合后加入
混合后加入![]() 的乙醛溶液
的乙醛溶液![]() ,加热煮沸观察沉淀的颜色
,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
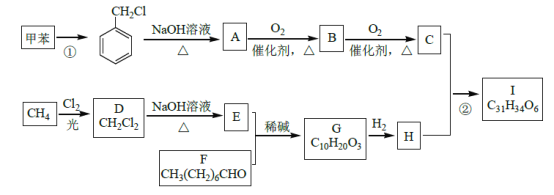
已知:a. 
![]()
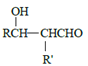
b. 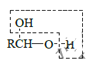
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件,W的可能结构有__种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A![]() B---
B---![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,能一步实现下图所示①~⑤转化关系的是

X | Y | Z | W | |
A | C | CO | CO2 | Na2CO3 |
B | Fe3O4 | Fe | FeCl2 | FeCl3 |
C | H2SO4 | SO2 | S | SO3 |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
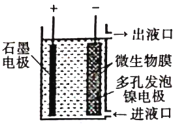
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢材在社会发展中应用广泛。为研究某种碳素钢(含少量碳和硫)的成分,科研小组进行了如下探究活动:称取碳素钢(已除表面氧化物)97.50 g放入耐高温反应管中与O2反应,除去未反应的O2,收集到干燥混合气体X 1.12 L(已折算成标准状况下的体积)。
(1)碳素钢属于___________材料(填标号)
A.有机高分子材料 B.金属材料 C.无机非金属材料 D.复合材料
(2)科研小组用下图所示实验装置检验混合气体X的组成。
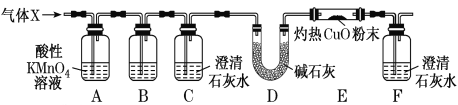
①装置B中的试剂是______________,装置C的作用是______________。
②若观察到_________________(填实验现象),证明X中含有CO。
(3)反应后,耐高温反应管内固体中除含有Fe3+之外,还可能含有Fe2+。要确定其中的Fe2+,可选用________(填序号)。
a.稀H2SO4和KMnO4溶液 b.KSCN溶液和铁粉
c.稀盐酸和K3[Fe(CN)6]溶液 d.KSCN溶液和氯水
(4)科研小组用下图所示装置(部分)测定SO2的体积分数,并计算碳素钢的含碳量。将气体X 缓慢通过实验装置,当观察到___________________(填实验现象)时,停止通气,此时气体流量仪显示的流量为224 mL(已换算成标准状况下的体积)。装置Ⅲ中的化学反应方程式为________________,碳素钢中碳元素的质量分数为_________(保留1位小数)。
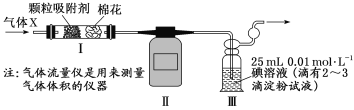
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:___;农业上用石膏降低其碱性的反应原理:___;
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m__n(填“>”“<”或“=”)
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__;
(4)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。
)=c(Cl-),则溶液显__(填“酸”“碱”或“中”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备![]() 的步骤如下:
的步骤如下:
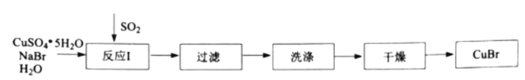
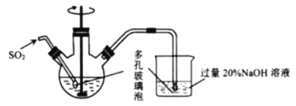
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________(写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成![]() 的离子方程式为________;烧杯中发生反应的化学方程式为________。
的离子方程式为________;烧杯中发生反应的化学方程式为________。
(3)过滤步骤中,需要在避光的条件下进行,原因是________。
(4)洗涤步骤中,依次用溶有少量![]() 的水、溶有少量
的水、溶有少量![]() 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有![]() ”的原因是________。
”的原因是________。
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水![]() 晶体。
晶体。
(水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布,
的分布,![]() 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。
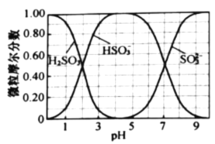
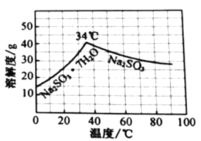
请补充完整实验方案[须用到![]() (贮存在钢瓶中)、
(贮存在钢瓶中)、![]() 计]:
计]:
①________;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com