
ЁОЬтФПЁПИпбЊжЌЪЧвЛжжГЃМћЕФаФбЊЙмМВВЁЃЌжЮСЦИпбЊжЌЕФаТвЉIЕФКЯГЩТЗЯпШчЯТЃК
вбжЊЃКa. 
![]()
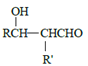
b. 
![]() RCHO
RCHO
c.EЪЧМзШЉ
ЛиД№ЯТСаЮЪЬтЃК
(1)ЗДгІЂйЫљашЪдМСЁЂЬѕМўЗжБ№ЪЧ____________ЃЛF ЕФЛЏбЇУћГЦЮЊ____________ЁЃ
(2)ЂкЕФЗДгІРраЭЪЧ______________ЃЛAЁњB ЕФЛЏбЇЗНГЬЪНЮЊ_________________ЁЃ
(3)G ЕФНсЙЙМђЪНЮЊ______________ЃЛH жаЫљКЌЙйФмЭХЕФУћГЦЪЧ____________ЁЃ
(4)ЛЏКЯЮяW ЕФЯрЖдЗжзгжЪСПБШЛЏКЯЮяC Дѓ14ЃЌЧвТњзуЯТСаЬѕМўЃЌWЕФПЩФмНсЙЙга__жжЁЃЦфжаКЫДХЙВеёЧтЦзЯдЪОга5 жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЗхУцЛ§БШЮЊ2:2:2:1:1ЃЌаДГіЗћКЯвЊЧѓЕФW ЕФНсЙЙМђЪН____________ЁЃ
ЂйгіFeCl3ШмвКЯдзЯЩЋ ЂкЪєгкЗМЯузхЛЏКЯЮя ЂлФмЗЂЩњвјОЕЗДгІ
(5)ЩшМЦгУМзБНКЭввШЉЮЊдСЯжЦБИ ЕФКЯГЩТЗЯпЃЌЦфЫћЮоЛњЪдМСШЮбЁ________(КЯГЩТЗЯпГЃгУЕФБэЪОЗНЪНЮЊЃКA
ЕФКЯГЩТЗЯпЃЌЦфЫћЮоЛњЪдМСШЮбЁ________(КЯГЩТЗЯпГЃгУЕФБэЪОЗНЪНЮЊЃКA![]() B---
B---![]() ФПБъВњЮя)
ФПБъВњЮя)
ЁОД№АИЁПCl2ЁЂЙтее аСШЉ ШЁДњЗДгІ 2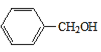 +O2
+O2![]() 2
2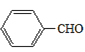 +2H2O
+2H2O  єЧЛљ 13
єЧЛљ 13 ![]()
![]()
![]()
![]()
ЁОНтЮіЁП
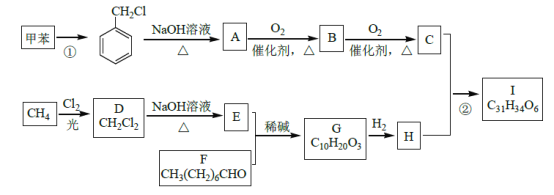
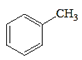
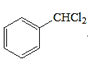
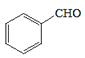
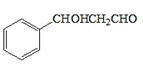
ЗжЮівбжЊaПЩжЊЃЌИУЗДгІЪЧвЛЗжзгШЉЕФєЪЛљБЛСэвЛЗжзгШЉ(Дг-CHOЯрСЌЕФЬМЩЯЖЯМќ)МгГЩЃЛЗжЮівбжЊbПЩжЊЃЌвЛИіЬМЩЯСЌ2Иі-OHВЛЮШЖЈЃЌЛсЭбЫЎГЩєЪЛљЁЃдкДЫШЯЪЖЛљДЁЩЯЃЌ
ИљОнЬтвтНјааЗжЮіЃЌЩњГЩCЕФТЗЯпгІЮЊЃКМзБНгыCl2ЗЂЩњШЁДњЗДгІЃЌЕУЕН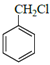 ЃЌдйКЭNaOHШмвКЗДгІЩњГЩA(
ЃЌдйКЭNaOHШмвКЗДгІЩњГЩA( )ЃЌОбѕЛЏЕУЕНB(
)ЃЌОбѕЛЏЕУЕНB( )ЃЌдйбѕЛЏЮЊC(
)ЃЌдйбѕЛЏЮЊC(![]() )ЃЛЩњГЩHЕФТЗЯпгІЮЊЃКCH4КЭCl2ЗЂЩњШЁДњЗДгІЃЌЕУЕНCH2Cl2ЃЌдйЫЎНтВЂАДвбжЊbЗДгІБфЛЏЕУЕНE(HCHO)ЃЌEгыF[CH3(CH2)6CHO]АДвбжЊaЗДгІЕУЕНG(
)ЃЛЩњГЩHЕФТЗЯпгІЮЊЃКCH4КЭCl2ЗЂЩњШЁДњЗДгІЃЌЕУЕНCH2Cl2ЃЌдйЫЎНтВЂАДвбжЊbЗДгІБфЛЏЕУЕНE(HCHO)ЃЌEгыF[CH3(CH2)6CHO]АДвбжЊaЗДгІЕУЕНG(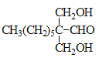 )ЃЌGгыH2МгГЩЕУЕНH(
)ЃЌGгыH2МгГЩЕУЕНH( )ЁЃЫсCКЭДМHЗЂЩњѕЅЛЏЗДгІЕУЕНIЁЃОнДЫВЂИљОнЯрЙигаЛњжЊЪЖПЩНтИїаЁЬтЁЃ
)ЁЃЫсCКЭДМHЗЂЩњѕЅЛЏЗДгІЕУЕНIЁЃОнДЫВЂИљОнЯрЙигаЛњжЊЪЖПЩНтИїаЁЬтЁЃ
(1)ЗДгІЂйЮЊМзБНгыCl2ЗЂЩњШЁДњЗДгІЃЌЕУЕН ЃЌЙЪЫљашЪдМСЪЧCl2ЃЌЬѕМўЪЧЙтееЃЛFЮЊКЌ8ИіЬМЕФШЉЃЌУћГЦЮЊаСШЉЁЃД№АИЮЊЃКCl2ЁЂЙтееЃЛаСШЉ
ЃЌЙЪЫљашЪдМСЪЧCl2ЃЌЬѕМўЪЧЙтееЃЛFЮЊКЌ8ИіЬМЕФШЉЃЌУћГЦЮЊаСШЉЁЃД№АИЮЊЃКCl2ЁЂЙтееЃЛаСШЉ
(2) ИљОнЗжЮіПЩжЊЃЌ ОЫЎНтВЂСЌајбѕЛЏЕУЕНЕФCЪЧЫсЃК
ОЫЎНтВЂСЌајбѕЛЏЕУЕНЕФCЪЧЫсЃК![]() ЃЛ CH4КЭCl2ОШЁДњЁЂЫЎНтЁЂАДвбжЊaЗДгІЕУЕНGЁЂгыH2МгГЩЕУЕНЕФHЪЧДМЃК
ЃЛ CH4КЭCl2ОШЁДњЁЂЫЎНтЁЂАДвбжЊaЗДгІЕУЕНGЁЂгыH2МгГЩЕУЕНЕФHЪЧДМЃК  ЁЃЫсCКЭДМHЩњГЩIЗЂЩњЕФЪЧШЁДњЗДгІ(ѕЅЛЏЗДгІ)ЃЌЫљвдЂкЕФЗДгІРраЭЪЧШЁДњЗДгІЃЛAЁњB ЪЧБНМзДМбѕЛЏЮЊБНМзШЉЃЌЙЪЛЏбЇЗНГЬЪНЮЊЃК2
ЁЃЫсCКЭДМHЩњГЩIЗЂЩњЕФЪЧШЁДњЗДгІ(ѕЅЛЏЗДгІ)ЃЌЫљвдЂкЕФЗДгІРраЭЪЧШЁДњЗДгІЃЛAЁњB ЪЧБНМзДМбѕЛЏЮЊБНМзШЉЃЌЙЪЛЏбЇЗНГЬЪНЮЊЃК2 +O2
+O2![]() 2
2 +2H2OЁЃД№АИЮЊЃКШЁДњЗДгІЃЛ2
+2H2OЁЃД№АИЮЊЃКШЁДњЗДгІЃЛ2 +O2
+O2![]() 2
2 +2H2O
+2H2O
(3) ИљОнЗжзгЪНЃКE(HCHO)ЁЂF(C8H16O)ЁЂG(C10H20O3)ЃЌвдМАвбжЊaаХЯЂПЩжЊЃЌEКЭFАД2ЃК1ЗДгІЕУЕНGЁЃгЩгкHCHOЗжзгжаЃЌ-CHOУЛгаЯрСЌЕФЬМЃЌЫљвдHCHOБЛМгГЩЃЌдђGЕФНсЙЙМђЪНЮЊЃК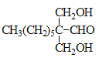 ЃЛGгыH2МгГЩКѓЕУЕНЕФHЮЊШ§дЊДМЃЌЫљвдH жаЫљКЌЙйФмЭХЕФУћГЦЪЧєЧЛљЁЃД№АИЮЊЃК
ЃЛGгыH2МгГЩКѓЕУЕНЕФHЮЊШ§дЊДМЃЌЫљвдH жаЫљКЌЙйФмЭХЕФУћГЦЪЧєЧЛљЁЃД№АИЮЊЃК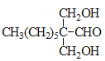 ЃЛєЧЛљ
ЃЛєЧЛљ
(4) ИљОнвдЩЯЗжЮіЃЌПЩжЊCЕФНсЙЙЮЊ![]() ЁЃЛЏКЯЮяWЕФЯрЖдЗжзгжЪСПБШCДѓ14ЃЌПЩЭЦЖЯЪЧЖрСЫвЛИіБЅКЭЬМ(1ИіCЁЂ2ИіH)ЃЌгЩЂйгіFeCl3ШмвКЯдзЯЩЋЁЂЂкЪєгкЗМЯузхЛЏКЯЮяЁЂЂлФмЗЂЩњвјОЕЗДгІЃЌПЩЭЦЖЯWКЌвЛИіБНЛЗЁЂвЛИіЗгєЧЛљЁЂвЛИіШЉЛљЃЌЛЙгавЛИіБЅКЭЬМЁЃПЩЯШЛГіЙЧМмЃЌдйНЋШЉЛљСЌЩЯЃК
ЁЃЛЏКЯЮяWЕФЯрЖдЗжзгжЪСПБШCДѓ14ЃЌПЩЭЦЖЯЪЧЖрСЫвЛИіБЅКЭЬМ(1ИіCЁЂ2ИіH)ЃЌгЩЂйгіFeCl3ШмвКЯдзЯЩЋЁЂЂкЪєгкЗМЯузхЛЏКЯЮяЁЂЂлФмЗЂЩњвјОЕЗДгІЃЌПЩЭЦЖЯWКЌвЛИіБНЛЗЁЂвЛИіЗгєЧЛљЁЂвЛИіШЉЛљЃЌЛЙгавЛИіБЅКЭЬМЁЃПЩЯШЛГіЙЧМмЃЌдйНЋШЉЛљСЌЩЯЃК![]() ЁЂ
ЁЂ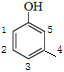 ЁЂ
ЁЂ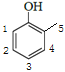 (Ъ§зжЫљЪОЮЊ-CHOПЩФмСЌЕУЮЛжУ)ЃЌЙВМЦ13жжЃЛВЛФбевГіЃЌКЫДХЙВеёЧтЦзЯдЪОга5 жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗхУцЛ§БШЮЊ2ЃК2ЃК2ЃК1ЃК1ЕФЭЌЗжвьЙЙЬхЮЊЃК
(Ъ§зжЫљЪОЮЊ-CHOПЩФмСЌЕУЮЛжУ)ЃЌЙВМЦ13жжЃЛВЛФбевГіЃЌКЫДХЙВеёЧтЦзЯдЪОга5 жжВЛЭЌЛЏбЇЛЗОГЕФЧтЃЌЧвЗхУцЛ§БШЮЊ2ЃК2ЃК2ЃК1ЃК1ЕФЭЌЗжвьЙЙЬхЮЊЃК![]() ЁЃД№АИЮЊЃК13ЃЛ
ЁЃД№АИЮЊЃК13ЃЛ![]()
(5)ИљОнФПБъВњЮя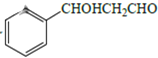 ЕФНсЙЙМАЬтжавбжЊaЃЌПЩЭЦЖЯИУВњЮяПЩгЩБНМзШЉКЭввШЉЗДгІЖјРДЃЛБНМзШЉПЩгЩ
ЕФНсЙЙМАЬтжавбжЊaЃЌПЩЭЦЖЯИУВњЮяПЩгЩБНМзШЉКЭввШЉЗДгІЖјРДЃЛБНМзШЉПЩгЩ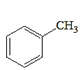 гыCl2ЕФМгГЩВњЮя
гыCl2ЕФМгГЩВњЮя ЫЎНтВЂАДвбжЊbЕФЗНЪНЖјЕУЕНЁЃЫљвдКЯГЩТЗЯпЮЊЃК
ЫЎНтВЂАДвбжЊbЕФЗНЪНЖјЕУЕНЁЃЫљвдКЯГЩТЗЯпЮЊЃК
![]()

![]()

![]() ЁЃ
ЁЃ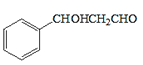 ЁЃ
ЁЃ


 ПЮЬУШЋНтзжДЪОфЖЮЦЊеТЯЕСаД№АИ
ПЮЬУШЋНтзжДЪОфЖЮЦЊеТЯЕСаД№АИ ВНВНИпПкЫуЬтПЈЯЕСаД№АИ
ВНВНИпПкЫуЬтПЈЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯжгаЫФжждЊЫиЕФЛљЬЌдзгЕФЕчзгХХВМЪН:
Ђй ![]() ;Ђк
;Ђк ![]() ;Ђл
;Ђл ![]() ;Ђм
;Ђм ![]() ЁЃ
ЁЃ
дђЯТСагаЙиБШНЯжае§ШЗЕФЪЧ( )
A.ЕквЛЕчРыФм:Ђм>Ђл>Ђк>Ђй
B.дзгАыОЖ:Ђм>Ђл>Ђк>Ђй
C.ЕчИКад:Ђм>Ђл>Ђк>Ђй
D.зюИпе§ЛЏКЯМл:Ђм>Ђл=Ђк>Ђй
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЮяжЪЕФзщГЩЁЂНсЙЙКЭаджЪЕФЫЕЗЈжае§ШЗЕФЪЧ
A.гУИЪАБЫс(![]() )КЭБћАБЫс(
)КЭБћАБЫс(![]() )ЫѕКЯзюЖрПЩаЮГЩЫФжжЖўыФ
)ЫѕКЯзюЖрПЩаЮГЩЫФжжЖўыФ
B.ХЈСђЫсПЩвдЪЙЕААзжЪБфЛЦЃЌГЦЮЊбеЩЋЗДгІЃЌГЃгУРДМјБ№ВПЗжЕААзжЪ
C.дквЛЖЈЬѕМўЯТЃЌCH3CO18OHКЭC2H5OHЗДгІПЩЩњГЩ CH3CO18OC2H5
D.HCOOHгыOHCCH2OHЪєгкЭЌЯЕЮяЃЌОљФмЪЙЫсадKMnO4ШмвКЭЪЩЋ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЭЌЗжвьЙЙЬхЕФЫЕЗЈе§ШЗЕФЪЧ
A.МзДМдкЭДпЛЏКЭМгШШЬѕМўЯТЩњГЩЕФВњЮяВЛДцдкЭЌЗжвьЙЙЬх
B.2-ТШЖЁЭщЃЈCH3CHClCH2CH3ЃЉгыNaOHввДМШмвКЙВШШЃЌЕУЕНШ§жжЯЉЬўЁЃ
C.гаЛњЮя![]() ЕФЭЌЗжвьЙЙЬхжаЃЌЦфжаЪєгкѕЅЧвБНЛЗЩЯга2ИіШЁДњЛљЕФЭЌЗжвьЙЙЬхга2жжЁЃ
ЕФЭЌЗжвьЙЙЬхжаЃЌЦфжаЪєгкѕЅЧвБНЛЗЩЯга2ИіШЁДњЛљЕФЭЌЗжвьЙЙЬхга2жжЁЃ
D.ЗжзгЪНЮЊC5H10O2ЕФгаЛњЮяжаКЌга![]() НсЙЙЕФЭЌЗжвьЙЙЬхга12жж
НсЙЙЕФЭЌЗжвьЙЙЬхга12жж
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаРызгЗНГЬЪНе§ШЗЕФЪЧ
A.СђЫсТСШмвКжаМгШыЙ§СПАБЫЎЃКAl3ЃЋЃЋ4OHЃ=AlO![]() ЃЋ2H2O
ЃЋ2H2O
B.ЖўбѕЛЏСђгыЫсадИпУЬЫсМиШмвКЗДгІЃК5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3ШмвКгыЯЁH2SO4ЗДгІЕФРызгЗНГЬЪНЃКS2O![]() +6H+=2SЁ§+3H2O
+6H+=2SЁ§+3H2O
D.СђЫсЭШмвКжаМгЩйСПЕФЬњЗлЃК3Cu2++2Fe=2Fe3++3Cu
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПМзДМШМСЯЕчГиЪЧФПЧАгІгУБШНЯЙуЗКЕФвЛжжШМСЯЕчГиЃЌЦфЙЄзїдРэШчЯТЭМЫљЪОЃК

ЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A.NЮЊе§МЋЃЌЗЂЩњбѕЛЏЗДгІ
B.aЮЊбѕЦјЃЌbЮЊМзДМ
C.МзГиШмвКpHдіДѓЃЌввГиШмвКpHМѕаЁ
D.Шєга1 mol CO2ЩњГЩЃЌдђга6 mol HЃЋДгМзГиЭИЙ§НЛЛЛФЄНјШыввГи
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЮвЙњгЕгазджїжЊЪЖВњШЈЕФяЈ(Rb)дзгжгЃЌУП3000ЭђФъЮѓВюНі1УыЁЃRbЪЧЕкЮхжмЦкЕкЂёAзхдЊЫиЃЌЯТСаЙигк37RbЕФЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.дЊЫиЕФН№ЪєадЃКKЃОRb
B.жазгЪ§ЮЊ50ЕФRbЕФКЫЫиЃК![]() Rb
Rb
C.гыЭЌжмЦкдЊЫи53IЕФдзгАыОЖБШЃКRbЃМI
D.зюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЕФМюадЃКKOHЃМRbOH
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЫЎШШЗЈжЦБИFe3O4ФЩУзПХСЃЕФзмЗДгІЕФРызгЗНГЬЪНЮЊ3Fe2ЃЋЃЋ2![]() ЃЋO2ЃЋ4OHЃ===Fe3O4ЃЋ
ЃЋO2ЃЋ4OHЃ===Fe3O4ЃЋ![]() ЃЋ2H2OЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ()
ЃЋ2H2OЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ()
A.O2КЭ![]() ЪЧбѕЛЏМСЃЌFe2ЃЋЪЧЛЙдМС
ЪЧбѕЛЏМСЃЌFe2ЃЋЪЧЛЙдМС
B.ВЮМгЗДгІЕФбѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ1ЁУ5
C.УПЩњГЩ1mol![]() зЊвЦ2molЕчзг
зЊвЦ2molЕчзг
D.УП2molFe2ЃЋБЛбѕЛЏЃЌдђБЛFe2ЃЋЛЙдЕФO2ЮЊ0.5mol
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛецПеШнЦїжаГфШы2molSO2КЭ1molO2ЃЌЗЂЩњЗДгІ2SO2(g)+O2(g)![]() 2SO3(g)ЃЌдквЛЖЈЬѕМўЯТДяЕНЦНКтЪБЃЌSO2ЕФзЊЛЏТЪЮЊ85%ЁЃШєдкЭЌвЛШнЦїжаЃЌдкЯрЭЌЮТЖШЯТЯђШнЦїжаГфШыSO3ЃЌгћЪЙДяЕНЦНКтЪБЃЌИїГЩЗжЕФЬхЛ§ЗжЪ§гыЩЯЪіЦНКтЯрЭЌЃЌдђЦ№ЪМЪБSO3ЕФЮяжЪЕФСПКЭДяЕНЦНКтЪБSO3ЕФзЊЛЏТЪЮЊЃЈ ЃЉ
2SO3(g)ЃЌдквЛЖЈЬѕМўЯТДяЕНЦНКтЪБЃЌSO2ЕФзЊЛЏТЪЮЊ85%ЁЃШєдкЭЌвЛШнЦїжаЃЌдкЯрЭЌЮТЖШЯТЯђШнЦїжаГфШыSO3ЃЌгћЪЙДяЕНЦНКтЪБЃЌИїГЩЗжЕФЬхЛ§ЗжЪ§гыЩЯЪіЦНКтЯрЭЌЃЌдђЦ№ЪМЪБSO3ЕФЮяжЪЕФСПКЭДяЕНЦНКтЪБSO3ЕФзЊЛЏТЪЮЊЃЈ ЃЉ
A.2mol85%B.1mol42.5%C.2mol15%D.1mol30%
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com