
【题目】下列离子方程式正确的是
A.硫酸铝溶液中加入过量氨水:Al3++4OH-=AlO![]() +2H2O
+2H2O
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+
+4H+
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O
+6H+=2S↓+3H2O
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe=2Fe3++3Cu
【答案】B
【解析】
A.由于氨水是弱电解质在书写离子反应方程式时不能拆,且Al(OH)3不溶于氨水中,故硫酸铝溶液中加入过量氨水正确离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3![]() ,A错误;
,A错误;
B.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO![]() =2Mn2++5SO
=2Mn2++5SO![]() +4H+,B正确;
+4H+,B正确;
C.Na2S2O3溶液与稀H2SO4反应的离子方程式:S2O![]() +6H+=2S↓+3H2O,该离子方程式电荷不守恒,正确写法为:S2O
+6H+=2S↓+3H2O,该离子方程式电荷不守恒,正确写法为:S2O![]() +2H+=S↓+H2O+SO2↑,C错误;
+2H+=S↓+H2O+SO2↑,C错误;
D.硫酸铜溶液中加少量的铁粉只能生成Fe2+,正确写法为:Cu2++Fe=Fe2++Cu,D错误;
故答案为:B。


科目:高中化学 来源: 题型:
【题目】荧光材料硫化锌(ZnS)的研究至今已有 150 多年的历史,可用于制白色颜料、发光粉、发光油漆等,其久置于湿空气中易被氧化为 ZnSO4。请回答下列问题:
(1)基态 Zn 原子的电子排布式为_________________________,核外电子占据最高能层的符号是__________________________, 占据该能层电子的电子云轮廓图形状为__________________________。
(2)ZnSO4 中三种元素的电负性由大到小的顺序为__________________________,![]() 的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
的立体构型为__________________________,其中 S 的杂化轨道类型为__________________________。
(3)ZnSO4 溶于氨水可生成[Zn(NH3)4]SO4 溶液,[Zn(NH3)4]SO4 溶液中不存在的微粒间作用力有__________________________。
A.离子键B.共价键C.配位键D.范德华力
(4)根据下列锌卤化物的熔点和溶解性,判断 ZnF2 晶体的类型为______;分析 ZnCl2、ZnBr2、ZnI2 熔点依次增大的原因__________________________。
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
在乙醇、乙醚中的溶解性 | 不溶 | 溶解 | 溶解 | 溶解 |
(5) 立方 ZnS 晶体的密度为 ρ g/cm3,其晶胞结构如图。

S2-周围等距离且最近的 Zn2+为__________________________;ZnS晶胞中的晶胞参数 a=__________________________nm(列出计算式)。[ M(ZnS)=97 g/mol ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_________。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 范德华力 E 配位键
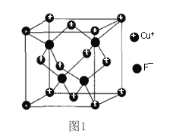
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是_____________;
②CuF的晶胞结构如图1。F-填充在Cu+围成的_______空隙中,空隙填充率为________%。
Ⅱ.AA705合金(含Cu、Al、Zn、Mg和Ti)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。
(5)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含________ molσ键,中心离子的配位数为__________。
钛晶体有两种品胞,如图所示。
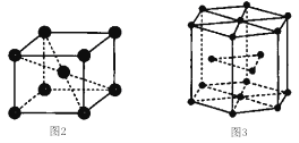
①如图2所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图3中六棱柱边长为x pm,高为y pm。该钛晶胞密度为D g·cm-3,NA为______mol-1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物广泛应用于金属冶炼、有机合成等领域。
(1)铝热反应可以冶炼金属铬,Cr基态核外电子排布式为______。
(2)AlCl3可作以下反应的催化剂。
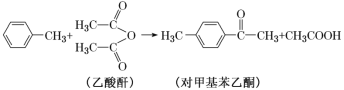
①乙酸酐分子中碳原子轨道的杂化类型为______。
②1 mol对甲基苯乙酮分子中含有的σ键为______。
③CH3COOH与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为__________。
④单个AlCl3气态分子的空间构型为___________,AlCl3可与Cl-形成![]() ,与
,与![]() 互为等电子体的分子为________。
互为等电子体的分子为________。
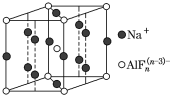
(3)某遮光剂的晶胞如图所示,由晶胞可知n=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高血脂是一种常见的心血管疾病,治疗高血脂的新药I的合成路线如下:
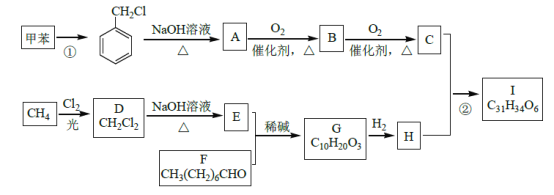
已知:a. 
![]()
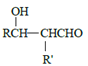
b. 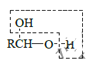
![]() RCHO
RCHO
c.E是甲醛
回答下列问题:
(1)反应①所需试剂、条件分别是____________;F 的化学名称为____________。
(2)②的反应类型是______________;A→B 的化学方程式为_________________。
(3)G 的结构简式为______________;H 中所含官能团的名称是____________。
(4)化合物W 的相对分子质量比化合物C 大14,且满足下列条件,W的可能结构有__种。其中核磁共振氢谱显示有5 种不同化学环境的氢,峰面积比为2:2:2:1:1,写出符合要求的W 的结构简式____________。
①遇FeCl3溶液显紫色 ②属于芳香族化合物 ③能发生银镜反应
(5)设计用甲苯和乙醛为原料制备 的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A
的合成路线,其他无机试剂任选________(合成路线常用的表示方式为:A![]() B---
B---![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B.有机物![]() 的消去产物有2种
的消去产物有2种
C.鉴别乙醇和苯:将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中
D.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CHCOOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )
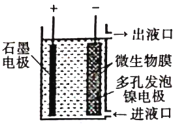
A. 若加人的是![]() 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性
B. 镍电极上的电极反应式为:![]()
C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成![]() 气体,理论上可除去
气体,理论上可除去![]() mol
mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu-ZnO-ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是
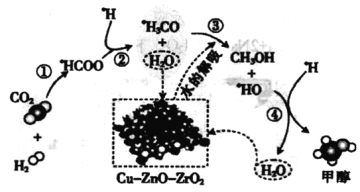
A.催化剂不能提高二氧化碳加氢制甲醇的过程中原子利用率
B.该反应过程中,涉及了极性共价键的断裂和生成
C.第③步的反应式为*H3CO+H2O→CH3O*H+HO
D.向该反应体系中加入少量的水能增加甲醇的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com