
【题目】溴化亚铜是一种白色粉末,不溶于冷水,在热水中或见光都会分解,在空气中会慢慢被氧化。实验室制备![]() 的步骤如下:
的步骤如下:
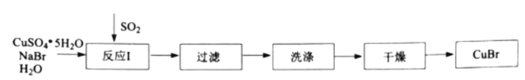
(1)反应Ⅰ在如图所示实验装置的三颈烧瓶中进行,实验所用蒸馏水需经煮沸,目的是除去水中的_________(写化学式)。
(2)反应Ⅰ中:三颈烧瓶中反应生成![]() 的离子方程式为________;烧杯中发生反应的化学方程式为________。
的离子方程式为________;烧杯中发生反应的化学方程式为________。
(3)过滤步骤中,需要在避光的条件下进行,原因是________。
(4)洗涤步骤中,依次用溶有少量![]() 的水、溶有少量
的水、溶有少量![]() 的乙醇、纯乙醚洗涤。洗涤剂需“溶有
的乙醇、纯乙醚洗涤。洗涤剂需“溶有![]() ”的原因是________。
”的原因是________。
(5)欲利用上述装置烧杯中的吸收液制取较纯净的无水![]() 晶体。
晶体。
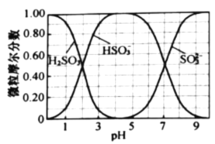
(水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布,
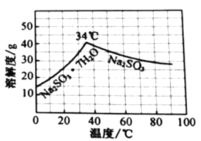
的分布,![]() 的溶解度曲线如题图所示)。
的溶解度曲线如题图所示)。
请补充完整实验方案[须用到![]() (贮存在钢瓶中)、
(贮存在钢瓶中)、![]() 计]:
计]:
①________;
②加入少量维生素C溶液(抗氧剂),加热浓缩溶液至有大量晶体析出;
③________;
④用无水乙醇洗涤2-3次;
⑤放真空干燥箱中干燥。
【答案】![]()
![]()
![]() 防止
防止![]() 见光分解 防止
见光分解 防止![]() 被氧化 向烧杯中继续通入
被氧化 向烧杯中继续通入![]() ,用
,用![]() 计测量溶液的
计测量溶液的![]() ,若
,若![]() 约为10,停止通
约为10,停止通![]() 在高于34℃条件下趁热过滤
在高于34℃条件下趁热过滤
【解析】
反应Ⅰ中,在三颈烧瓶中铜离子被![]() 还原为亚铜离子,与溴离子反应生成CuBr沉淀,再经过滤、洗涤、干燥得到
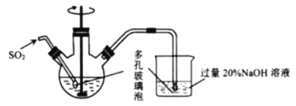
还原为亚铜离子,与溴离子反应生成CuBr沉淀,再经过滤、洗涤、干燥得到![]() ,烧杯中过量的NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境;同时需结合题干中有关物质性质的已知信息进行作答。
,烧杯中过量的NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境;同时需结合题干中有关物质性质的已知信息进行作答。
(1)由已知信息知,溴化亚铜能被氧气慢慢氧化,因此本实验反应Ⅰ中用二氧化硫还原铜离子生成溴化亚铜要排除空气中氧气的干扰,因此实验所用蒸馏水需经煮沸,目的是除去水中的![]() ;
;
(2)反应Ⅰ中,铜离子被二氧化硫还原成亚铜离子,与溴离子反应生成CuBr沉淀,根据得失电子守恒、电荷守恒、元素守恒配平该反应的离子方程式为: ![]() ;烧杯中NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境,NaOH溶液是过量的,则产物为Na2SO3,故发生反应的化学方程式为
;烧杯中NaOH溶液用于尾气处理,吸收多余的SO2气体,防止SO2逸出污染环境,NaOH溶液是过量的,则产物为Na2SO3,故发生反应的化学方程式为![]() ;
;
(3)由已知信息知,溴化亚铜见光会分解,所以过滤步骤中,需要在避光的条件下进行,是为了防止CuBr见光分解;
(4)由已知信息知,溴化亚铜在空气中会慢慢被氧化,所以洗涤步骤中,洗涤剂需“溶有![]() ”是为了防止
”是为了防止![]() 被氧化;
被氧化;
(5)上述装置烧杯中过量的NaOH溶液吸收![]() 生成
生成![]() ,且NaOH有剩余,因此为制取较纯净的无水
,且NaOH有剩余,因此为制取较纯净的无水![]() 晶体,结合水溶液中
晶体,结合水溶液中![]() 、
、![]() 、
、![]() 随
随![]() 的分布图可知:应先向烧杯中继续通入
的分布图可知:应先向烧杯中继续通入![]() ,与剩余的NaOH反应,并用
,与剩余的NaOH反应,并用![]() 计测量溶液的
计测量溶液的![]() ,若
,若![]() 约为10,停止通
约为10,停止通![]() ,从而得到
,从而得到![]() 溶液;根据
溶液;根据![]() 的溶解度曲线可知
的溶解度曲线可知![]() 在温度高于34℃的条件下溶解度逐渐减小,因此在加入少量维生素C溶液(抗氧剂),防止
在温度高于34℃的条件下溶解度逐渐减小,因此在加入少量维生素C溶液(抗氧剂),防止![]() 被氧化的同时,加热浓缩溶液至有大量晶体析出;再在高于34℃条件下趁热过滤,得到
被氧化的同时,加热浓缩溶液至有大量晶体析出;再在高于34℃条件下趁热过滤,得到![]() 晶体;再用无水乙醇洗涤2-3次,除去晶体表面的可溶性杂质;最后放真空干燥箱中干燥。
晶体;再用无水乙醇洗涤2-3次,除去晶体表面的可溶性杂质;最后放真空干燥箱中干燥。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2![]() +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+![]() +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()
A.O2和![]() 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂
B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol![]() 转移2mol电子
转移2mol电子
D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
A.2mol85%B.1mol42.5%C.2mol15%D.1mol30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
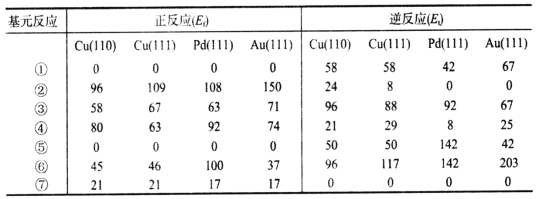
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
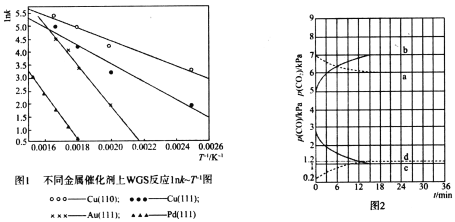
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据《化学反应原理》中相关知识,按要求作答。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于_____(填“吸热”或“放热")反应。
(2)盐酸是一种强酸,补充完整电离方程式:HCl=___+Cl- 。室温下,将大小相等的镁条和铁片投入同浓度的稀盐酸中,产生氢气的速率较大的是________。
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应____(填“是”或“不是”)氧化还原反应。
②室温下,84消毒液呈碱性,其pH___7 (填“>”或“<”)。
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中__具有很强的氧化性,可以使病毒和细菌失去生理活性;水解是吸热反应,升高温度平衡向_____(填“正反应”或“逆反应”)方向移动。
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):
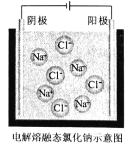
通电时,Na+向______(填“阳极”或“阴极")移动,写出生成金属钠的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50mol/LNaCl溶液480mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、_______以及等质量的两片纸片。
(2)计算。配制该溶液需取NaCl晶体_______g。
(3)配置过程。
①天平调零。
②称量过程中NaCl晶体应放于天平的_______(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
④溶解、冷却,该步实验中需要使用玻璃棒,目的是________。
⑤转移、洗涤。在转移时应使用_____引流,需要洗涤烧杯2-3次是为了______。
⑥定容、摇匀。
⑦将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
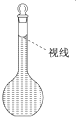
(4)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
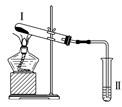
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com