
1L某混合溶液,只可能含有下表中的若干种离子:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
A.原溶液中加入盐酸有沉淀生成
B.原溶液中一定含有Cl-和Br-
C.反应最后得到的沉淀只有Fe(OH)3
D.反应最后形成的溶液中溶质只有NaAlO2

 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
下列关于指定粒子构成的几种描述中不正确的是
A.37Cl与39K具有相同的中子数
B.第114号元素的一种核素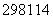 X与82Pb具有相同的最外层电子数
X与82Pb具有相同的最外层电子数
C.H3O+与OH-具有相同的质子数和电子数
D.O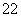 和S2-具有相同的质子数和电子数
和S2-具有相同的质子数和电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三种金属,两两分别接触并同处于稀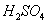 中,反应冒气泡,判断三种金属活动性顺序( )
中,反应冒气泡,判断三种金属活动性顺序( )

A、A>C>B
B、B>A>C
C、C>B>A
D、C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜、锌和稀硫酸组成的原电池中,下列各叙述正确的是( )
A.溶液pH由大变小 B.负极附近Zn2+浓度逐渐增大
C.H+向负极移动 D.溶液中H2SO4的浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿佛加德罗常数,下列说法正确的是( )
A.0. 2 mol过氧化氢完全分解转移的电子数目为0.4 NA
B.12.8g Cu与足量HNO3反应生成NO和NO2,转移电子数目为0.2 NA'
C.1L0.1 mol /L的Na2CO3溶液中CO32-的数目小于0.1NA
D.将含0.1 mol FeCl3的饱和溶液制成胶体后,生成0.1NA个Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.两个原子或多个原子之间的相互作用叫做共价键
B.阴、阳离子间通过静电引力而形成的化学键叫做离子键
C.只有金属元素和非金属元素化合时才能形成离子键
D.大多数的盐、碱和低价金属氧化物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
“笑气”(N2O)是人类最早应用于医疗的麻醉剂之一。有关理论认为N2O与CO2分子具有相似的结构(包括电子式);已知N2O分子中氧原子只与一个氮原子相连,下列说法合理的是
A.N2O与CO2为等电子体,具有相似的结构和相似的性质
B.N2O的电子式可表示为
C.N2O与CO2均不含非极性键
D.N2O为三角形分子
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1) 五种元素原子半径由大到小的顺序是(写元素符号)————————
(2) X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式)————
(3) 由以上某些元素组成的化合物A、B、C、D有如下转化关系
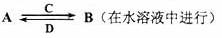
其中C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式——;D的电子式——
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为——
由A转化为B的离子方程式——————
②如果A由三种元素组成 ,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因——————————————————。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是——————————;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有————————————。
,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因——————————————————。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是——————————;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有————————————。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com