
【题目】.A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如图所示(反应条件及他物质已经略去);![]()
Ⅰ. 若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为__________________________,体现B的_____________(选填 “氧化性”“还原性”“漂白性”)
(2)98%的浓硫酸改为氧化物形式SO3·nH2O,则n值为_________(可写成分数形式)
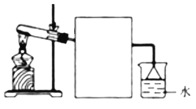
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出写出A→B的化学方程式_____________________________________________。
(2)实验室常用右图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图________。
(3)尾气处理装置中使用倒扣漏斗的作用是________________________。
【答案】紫色溶液褪色 还原性 ![]() 4NH3+5O2
4NH3+5O2 4NO+6H2O
4NO+6H2O ![]() 防止倒吸
防止倒吸
【解析】
Ⅰ.常温下A为淡黄色固体单质,即说明A是S,则B是二氧化硫,C是三氧化硫,D是硫酸。
Ⅱ.若A气体可使湿润的红色石蕊试纸变蓝,应为NH3,则B为NO,C为NO2,D为HNO3。
Ⅰ. (1)SO2有还原性会被高锰酸钾氧化,将SO2通入KMnO4溶液的现象为:紫色溶液褪色;体现SO2的还原性;
(2)设98%的浓硫酸质量为100g,则m(H2SO4)=100g×98%=98g,m(H2O)=100g-98g=2g,则n(H2SO4)=![]() =1mol,n(H2O)=
=1mol,n(H2O)= ![]() =
= ![]() mol,100g98%的浓硫酸中1mol硫酸分子等价1molSO3和1molH2O,水的总物质的量为
mol,100g98%的浓硫酸中1mol硫酸分子等价1molSO3和1molH2O,水的总物质的量为![]() mol+1mol=
mol+1mol=![]() ,改写为氧化物形式SO3·nH2O,则n=
,改写为氧化物形式SO3·nH2O,则n=![]() ;
;
Ⅱ.(1)由分析可知A为 NH3,B为NO,氨气的催化氧化可以生成NO,方程式为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(2)氨气密度比空气小,极易溶于水,不能用排水法收集,可以用向下排空气法收集,装置为![]()
(3) 尾气处理装置中使用倒扣漏斗的作用是:防止倒吸。


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的无毒与不致癌性有很多特殊用途,其化合物广泛应用于电子、医药等领域。由辉铋矿(主要成分为Bi2S3,含杂质PbO2等)制备Bi2O3的工艺如下:

回答下列问题:
(1)Bi位于元素周期表第六周期,与N、P同族,Bi的原子结构示意图为________。
(2)“浸出”时Bi2S3与FeCl3溶液反应的化学方程式为________,反应液必须保持强酸性,否则铋元素会以BiOCl(碱式氯化铋)形式混入浸出渣使产率降低,原因是________(用离子方程式表示)。

(3)“置换”时生成单质铋的离子方程式为________。“母液1”中通入气体X后可循环利用,气体X的化学式为________。
(4)“粗铋”中含有的杂质主要是Pb,通过熔盐电解精炼可达到除杂的目的,其装置示意图如右。电解后,阳极底部留下的为精铋。写出电极反应式:阳极________;阴极________。
(5)碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是________。“母液2”中可回收的主要物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如图:
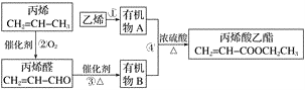
根据以上材料和你所学的化学知识,回答下列问题:
(1)乙烯的电子式是_____,官能团的名称是______。
(2)除去甲烷中的乙烯所用的试剂是____(填序号)。
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(3)反应①的化学方程式是______,反应类型是_____。
(4)反应④的化学方程式是______,反应类型是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】公元八世纪,Jabir ibn Hayyan在干馏硝石的过程中首次发现并制得硝酸(4KNO3![]() 2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
2K2O+4NO↑+3O2↑),同时他也是硫酸和王水的发现者。下列说法正确的是
A. 干馏产生的混合气体理论上可被水完全吸收
B. 王水是由3体积浓硝酸与1体积浓盐酸配制而成的
C. 王水溶解金时,其中的盐酸作氧化剂(Au+HNO3+4HCl=H[AuCl4]+NO↑+2H2O)
D. 实验室可用NaNO3与浓硫酸反应制备少量的HNO3,利用的是浓硫酸的氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,有强还原性。已知:①2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑,②H3PO2+NaOH(足量)=NaH2PO2+H2O。下列推断不正确的是
A. H3PO2的结构式为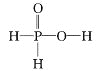
B. H3PO2具有强还原性,在空气中可能被氧化成磷酸
C. NaH2PO2是酸式盐
D. 每消耗1mol P4,反应①中转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出NaHCO3在水中的电离方程式:______________;NaOH溶液与NaHCO3溶液反应的离子方程式:________________。
(2)某无色透明溶液中可能大量存在NH4+、Na+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的几种离子。从其中取两份各100mL溶液,进行如下实验:
①根据溶液颜色可以判断溶液中不存在的离子是_____________;
②取其中的一份溶液进行实验,加入过量氢氧化钠浓溶液并加热,共生成448mL气体(标准状况下),有关的离子方程式为______________;
③取另一份溶液加入过量Ba(NO3)2溶液,生成3.94g白色沉淀,过滤,向沉淀中再加入足量稀盐酸,沉淀全部溶解;根据以上实验结果确定:原溶液中肯定存在的离子有___________;请你设计实验方案证明该溶液中是否含有Cl-?_____________ 。
(3)某氮肥厂的氨氮废水中氮元素多以NH4+和NH3·H2O的形式存在。该厂的技术团队设计该废水处理方案流程如下:
![]()
①过程Ⅱ:在微生物的作用下实现NH4+→NO2-→NO3-转化,称为硝化过程。在碱性条件下,NH4+被氧气(O2)氧化成NO3-的总反应的离子方程式为________________。
②过程Ⅲ:在一定条件下向废水中加入甲醇(CH3OH),实现HNO3→NO2-→N2转化,称为反硝化过程。反硝化过程中甲醇(C元素为-2价)转化为CO2,若有6molHNO3完全转化成N2,消耗的甲醇的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某品牌饮用矿物质水标签的部分内容。下列说法正确的是

A. 标签上给出的离子的物理量是物质的量浓度
B. 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之间
C. 该品牌饮用矿物质水中c(Mg2+)的最大值为2×10-4 mol/L
D. 一瓶该品牌饮用矿物质水中SO42-的物质的量不超过1×10-5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com