
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是_______;
(2)Y元素原子的价层电子的轨道表示式为_______,该元素的名称是_______;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为__________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由稳定性____________________、原因:____________________,沸点高低____________________、原因:____________________。
【答案】 1s22s22p63s23p63d104s24p3 As ![]() 氧 三角锥 As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高
氧 三角锥 As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O NH3>PH3>AsH3 因为键长越短,键能越大,化合物越稳定 NH3>AsH3>PH3 NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高
【解析】试题分析:(1)X原子4p轨道上有3个未成对电子,则其电子排布式为1s22s22p63s23p63d104s24p3,可推出其元素符号为As。
(2)Y原子最外层2p轨道上有2个未成对电子。可能是![]() 或
或![]() ,即Y可能为1s22s22p2或1s22s22p4,根据X2Y3,则Y只能是氧,Y元素原子的价层电子的轨道表示式为
,即Y可能为1s22s22p2或1s22s22p4,根据X2Y3,则Y只能是氧,Y元素原子的价层电子的轨道表示式为![]() ,该元素的名称是氧。
,该元素的名称是氧。
(3)X、Y、Z原子序数之和为42,则Z的原子序数为42-33-8=1,Z是氢,化合物XZ3为AsH3,与NH3结构相似,为三角锥形。
(4)由题给信息可知As2O3与Zn和H2SO4反应生成AsH3、ZnSO4和H2O,根据电子守恒和原子守恒配平得As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O。
(5)稳定性:NH3>PH3>AsH3,因为键长越短,键能越大,化合物越稳定 沸点:NH3>AsH3>PH3,NH3可以形成分子间氢键,沸点最高;AsH3相对分子质量比PH3大,分子间作用力大,因而AsH3的沸点比PH3高。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】只用一种试剂就可将AgNO3、KSCN、H2SO4、NaOH四种无色溶液区分,这种试剂是( )
A. Fe(NO3)3溶液 B. MgCl2溶液
C. BaCl2溶液 D. FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一只可爱的小猫若无其事地站在一块高分子合成材料板上,板下烈火灼烧.说明该高分子材料板一定具有的性质是
A.绝热性B.绝缘性C.导热性D.熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据最近的美国《农业研究》杂志报道,美国的科学家发现半胱氨酸能增强艾滋病感染者的免疫力,对控制艾滋病病毒的蔓延有奇效。已知半胱氨酸的结构简式为:
则下列说法错误的是 ( )。
A. 半胱氨酸属于氨基酸
B. 半胱氨酸是一种两性物质
C. 两分子半胱氨酸脱水形成的二肽结构简式为![]()
D. HS—CH2—CH2—COONH4可与NaOH溶液反应放出一种碱性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B. 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C. 将分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
D. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 常温下,100g 46%乙醇水溶液中含有H原子数为12 NA
B. 23g Na与足量O2反应,生成Na2O 和Na2O2 的混合物,转移的电子数为 NA
C. 标准状况下,2.24 LCCl4 含有的共价键数为0.4 NA
D. 1 molN2与4molH2反应生成的NH3分子数小于2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法不正确的是
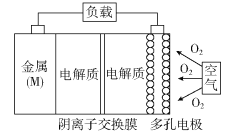
A. 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B. 比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高
C. M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D. 在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行以下可逆反应:M(g)+N(g)![]() P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )
P(g)+2L在不同的条件下P的百分含量P %的变化情况如下图,则该反应( )

A. 正反应放热,L是固体
B. 正反应放热,L是气体
C. 正反应吸热,L是气体
D. 正反应放热,L是固体或气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com