
【题目】50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:

(1)大小烧杯间填满碎泡沫塑料的作用是_______________。
(2)_________(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒。其原因是__________________。
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是________(填“偏高”“偏低”或“无影响”)。
(4)如果改用60mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_______(填“增加” “减少”或“不变”),理由是_____________;所求中和热数值_________(填“增加”“减少”或“不变”),理由是_______________;
(5)________(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是______________________.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/ ℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10—3kJ/(g·℃),则该反应的中和热为△H=____________(保留小数点后一位)。
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_______(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
【答案】(1)尽可能减少实验过程中的热量损失
(2)不能 金属易导热,热量散失较多(3)偏低
(4)增加 后者生成0.055molH2O,比前者生成0.05mol的H2O多
不变 中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关
(5)不能 Ba(OH)2和硫酸反应生成BaSO4沉淀时也有能量变化
(6)-56.5kJ/mol (7)acd
【解析】
试题分析:(1)根据量热计的构造和实验的成败关键来判断该装置的大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失;
(2)中和热测定实验成败的关键是保温工作,金属铜的导热效果好于环形玻璃搅拌棒;
(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小;
(4)反应放出的热量和所用酸以及碱的量的多少有关,50mL 1.0molL-1盐酸跟50mL 1.1molL-1氢氧化钠溶液进行反应,生成水的量为0.050mol,改用60mL 1.0molL-1盐酸跟50mL 1.1molL-1氢氧化钠溶液进行反应,生成0.055molH2O,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关;
(5)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,因为Ba(OH)2和硫酸反应生成BaSO4沉淀时也有能量变化;
(6)第一次温度差为7.6,第二次为6.7,第三次为6.8,第一明显大于二、三二次,舍去;取二、三二次平均值为6.75℃;每次50mL 1.Omol·L—1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液反应生成水的物质的量为0.05L×1.Omol·L—1=0.05mol;溶液的质量为100g,温度变化的值为△T=6.7℃,则生成0.05mol水放出的热量为Q=mc△T=100g×4.184J/(g℃)×6.75℃=2824.2J=2.824kJ,所以实验测得的中和热△H=-2.824kJ÷0.05mol=-56.5kJ/mol。
(7)a.实验装置保温、隔热效果差,热量散失较大,所得中和热的数值偏小,故a正确;b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,故b错误;c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;d.温度计测定NaOH溶液起始温度后直接插入稀HCl测温度,盐酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确;故答案为acd。


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
【题目】分子式为C5H8O2,与NaHCO3溶液反应放出CO2,且能使溴水褪色的有机物共有(不含立体异构)
A. 8种 B. 9种 C. 10种 D. 11种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向足量H2SO4溶液中加入100 mL 0.4 mol·L-1 Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )。
A.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1
B.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-18 kJ·mol-1
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1
C.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1[来源
D.Ba2+(aq)+SO![]() (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是 ( )
2Z(g)一定达到化学平衡状态的是 ( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmol Z,同时生成2nmol Y
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科大的科学家们将 C60 分子组装在一单层分子膜表面,在-268℃时冻结分子的热振荡,并利用扫描隧道显微镜首次“拍摄”到能清楚分辨碳原子间单、双键的分子图像。下列化合物分子中一定 既含单键又含双键的是( )
A. CO2 B. SO3 C. COCl2 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素原子的价电子排布式为(n-1)dansb,则下列说法正确的( )
A. 该元素是金属元素 B. 该元素位于周期表中d区
C. 该元素的族序数为a+b D. 该元素位于周期表中第四周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某+2价离子的电子排布式为1s22s22p63s23p63d9 ,该元素在周期表中所属的族是( )
A. ⅠB B. ⅡA C. Ⅷ D. ⅡB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个盛有催化剂的容积可变的密闭容器中,保持一定的温度和压强,进行以下反应:N2(g)+3H2(g)![]() 2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
2NH3(g),已知加入1mol N2和4mol H2时,达到平衡后生成amol NH3,在相同温度、压强下,保持平衡时各组分的体积分数不变,对①~③的状态,填写表中空白。
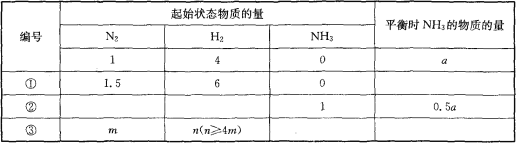
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究重点。 已知利用FeO与Fe3O4循环制氢的相关反应如下:
反应I. H2O(g)+3FeO(s) ![]() Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
Fe3O4 (s) + H2(g) △H=a kJ mo1-1;
反应II 2 Fe3O4(s) ![]() FeO (s) + O2(g) △H=b kJ mo1-1。
FeO (s) + O2(g) △H=b kJ mo1-1。
(1) 反应:2H2O(g)=2H2(g)+O2(g) △H =________(用含 a、b的代数式表示)kJ mo1-1。
(2)上述反应中a<0、b>0,从能源利用及成本的角度考虑,实现反应II可采用的方案是________。
(3)900℃时,在甲、乙两个体积均为2.0 L的密闭容器中分别投入0.60 mol FeO(s)并通入0.20 mol H2O(g),甲容器用 FeO细颗粒,乙容器用FeO粗颗粒。反应过程中H2的生成速率的变化如图1所示。
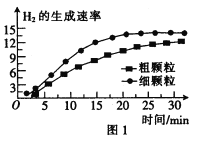
①用FeO细颗粒和FeO粗颗粒时,H2的生成速率不同的原因是__________。.
②用FeO细颗粒时H2O(g)的平衡转化率与用FeO粗颗粒时H2O(g)的平衡转化率的关系是___________(填“前者大”“前者小”或“相等”)。
(4)FeO的平衡转化率与温度的关系如图2所示。请在图3中画出1000℃、用FeO细颗粒时,H2O(g)转化率随时间的变化曲线(进行相应的标注)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com