
����Ŀ��һѧ�����������ʵ�鷽������NaCl��CaCl2���ֹ�������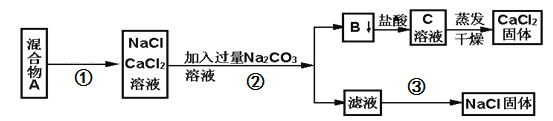
��պͻش���������
��1��д�������١��ڡ��۵����ƣ���________����_________����____________��
��2��д��B���������ᷴӦ�����ӷ���ʽ______________________________��
��3������ʵ�鷽������õ���NaCl���������������ʣ�����Ϊ����������ijһ�������ȱ�ݣ���һ������ȷ��Ʒ���Ӧ��______��
��4����Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ���һ���ʵ�����������������______��
���𰸡� �ܽ� ���� �����ᾧ CaCO3+2H+=Ca2++CO2��+H2O ������������������������ �����A
����������1���ӷ�������ͼ���Կ�������ˮ�ܽ�����̼���ƣ�̼�������Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ�Ȼ����˳�ȥ̼��Ƴ�����̼��������ᷴӦ�����Ȼ��ƣ�����Һ�����õ��Ȼ��ƣ��������ܽ⣬���ǹ��ˣ�����������
��2����ɫ����B��̼��ƣ�̼��ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��������Ӧ�����ӷ���ʽΪCaCO3+2H+=Ca2++CO2��+H2O��
��3�����̷�����֪���������Ǽ����˹���̼������Һ����Һ�г��Ȼ����⺬��̼���ƣ�Ӧ���������ȥ����ȷ��Ʒ���Ӧ�ǣ��ڲ����������Һ�м������������������������ҺpHֵΪ7�����ٽ��в�������
��4����Ҫ�ⶨ����Ʒ��NaCl��CaCl2����������Ҫ֪���Ȼ��ƺ��Ȼ��Ƶ���������������D������Ϊ�Ȼ��Ƶ����������������A����������õ��Ȼ��Ƶ�������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2�����ܱ�������,�������·�Ӧ: 2A(g)+ B(g) ![]() 2C(g)+D(g) ������������A��B����4 mol����ǰ10����A��ƽ����Ӧ�ٶ�Ϊ0.12 mol/��L������10����ʱ��������B�����ʵ����� ( )
2C(g)+D(g) ������������A��B����4 mol����ǰ10����A��ƽ����Ӧ�ٶ�Ϊ0.12 mol/��L������10����ʱ��������B�����ʵ����� ( )
A��1.6 mol B��2.8 mol C��2.4 mol D��1.2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����a��ʾ���ȷ�Ӧ�� ��
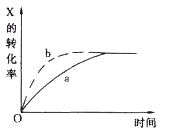
X��g��+Y��g��![]() Z��g��+M��g��+N��s�����й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ���� ��
Z��g��+M��g��+N��s�����й�����X��ת������ʱ��仯�Ĺ�ϵ����Ҫ�ı���ʼ������ʹ��Ӧ���̰�b���߽��У��ɲ�ȡ�Ĵ�ʩ���� ��
A�������¶� B���Ӵ�X��Ͷ���� C���Ӵ��� D���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ���Ӳ�ṹ��ͬ�������仯ѧ���ʡ�������
B. �������ڷǽ���Ԫ�غ���������Դ�����������ǿ
C. �ǽ���Ԫ�ص�ԭ����������γɵĻ����ﲻһ���ǹ��ۻ�����
D. Ԫ����������Ԫ��ԭ�Ӻ�������Ų������Ա仯�Ľ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Na2O2��SO3(g)�ķ�Ӧ������Na2O2��CO2(g)�ķ�Ӧ����д��Na2O2��SO3��Ӧ�Ļ�ѧ����ʽ��_____________________��
��ijѧ������С��ģ���������еķ�Ӧԭ�����������ͼ��ʾ����������ȡ���������������������ͼ������װ��E�ɼ���������������ɣ���������Ƥ����ͨ����װ������ˮ�����п̶ȣ�0��50mL���������ã��ҹܿ������ƶ�����Һ��ߵ͡�ʵ��ɹ�ѡ�õ�ҩƷ���У�ϡ���ᡢ���ᡢ�������ơ�̼���ơ�����ʯ��ˮ��
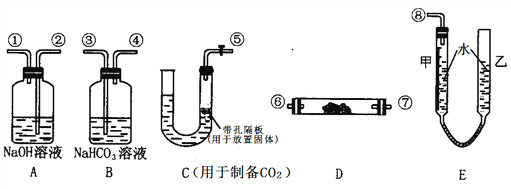
��ش��������⣺
��1��ͼ�и�װ�ýӿ�����˳����_____________________������ӿڵı�ţ��������ӽ��ܼ��г�װ�þ�ʡ�ԣ�����
�� �� �� �� �� �� �� �� ��
��2��װ��D�з�����Ӧ�Ļ�ѧ����ʽΪ��_______________��
��3��װ��B�������ǣ������ӷ���ʽ��ʾ����_______________��
��4��Ϊ�˽�ȷ������������������˱���������װ�õ�������֮�⣬�ڶ���Ӧǰ�����Һ��Ķ��������ֵ�Ĺ����У���Ӧע��_______������ĸ��ţ���
a��������Һ�尼Һ����ʹ���ƽ�Ŷ���
b���ȴ�����ָ����²Ŷ���
c�������ƶ��ҹܣ�ʹ��������Һ����ƽ�Ŷ���
��5��ʵ�����ռ��������ڱ�״�������ΪV L������뷴Ӧ��Na2O2 �����ʵ���Ϊ________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п����ΪʳƷпǿ������ԭ�ϡ���ҵ�ϳ�����п����������п����п�����Ҫ�ɷ���ZnCO3������������Fe2O3 ��FeCO3�� ��MgO��CaO�ȣ�������������ʾ�����£�
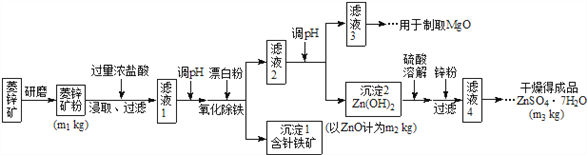
��ش��������⣺
��1������п����ĥ�ɷ۵�Ŀ���ǣ�______________________________��
��2��Ư�۵���Ч�ɷ���NaClO,����������������������з�Ӧ�����ӷ���ʽ��_______________________
��Fe(OH)2+ ��ClO- + ��_____�� ��Fe(OH)3 + �� Cl��
��3��������Goethite�����Ե¹�ʫ�˸�£�Goethe�����������ģ����Ԫ����Fe��O��H����Է�������Ϊ89����ѧʽ��____________�����ÿ��ǻ�ѧʽ�и�Ԫ�ص�����˳��
��4�������±����ݣ���������Һ2����pHʱ�������Ͽ�ѡ�õ��������Ϊ________________��
Mg(OH)2 | Zn(OH)2 | |
��ʼ������pH | 10.4 | 6.4 |
������ȫ��pH | 12.4 | 8.0 |
��ʼ�ܽ��pH | �� | 10.5 |
��5���������ת������ȫ������ͼ�����ݿ�֪����п�����ZnCO3��������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X2��Y2��Z2��W2�������ʵ���������W2��Z2��X2��Y2������������ԭ��Ӧ�ܷ�������
A��2NaW + Z2 = 2NaZ + W2 B��2NaW + X 2 = 2Na X + W2
C��2NaY + W2 = 2NaW + Y2 D��2NaZ + X2 = 2NaX + Z2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�ӦCu��4HNO3(Ũ)===Cu(NO3)2��2NO2����2H2O���ش��������⣺
(1)����������__________����ԭ������________��
(2)�������뻹ԭ�������ʵ���֮����________��
(3)����2 mol HNO3�μӷ�Ӧʱ����������������_____________ mol ������ת����ĿԼΪ________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������ķ�Ӧ���������������Ի�������Ⱦ����Ҫ���塣�����¶Ⱦ�������Ļ�ѧ��Ӧ����������2NO(g)+O2(g)![]() 2NO2(g)������ȴ�����¶ȵ����߶���С��ij��ѧС��Ϊ�о������������ʵ��ԭ��������֪2NO(g)+O2(g)
2NO2(g)������ȴ�����¶ȵ����߶���С��ij��ѧС��Ϊ�о������������ʵ��ԭ��������֪2NO(g)+O2(g)![]() 2NO2(g)�ķ�Ӧ���̷�������
2NO2(g)�ķ�Ӧ���̷�������
��2NO(g)![]() N2O2(g)(��)��v1��=k1��c2(NO)��v1��=k1��c(N2O2)H1<0
N2O2(g)(��)��v1��=k1��c2(NO)��v1��=k1��c(N2O2)H1<0
��N2O2(g)+O2(g)![]() 2NO2(g)(��)��v2��=k2��c(N2O2)c(O2)��v2��=k2��c2(NO2)H2<0
2NO2(g)(��)��v2��=k2��c(N2O2)c(O2)��v2��=k2��c2(NO2)H2<0
��ش�����������
��1����Ӧ2NO(g)+O2(g)![]() 2NO2(g)��H= (�ú�H1��H2��ʽ�ӱ�ʾ)��һ���¶��£���Ӧ2NO(g)+O2(g)
2NO2(g)��H= (�ú�H1��H2��ʽ�ӱ�ʾ)��һ���¶��£���Ӧ2NO(g)+O2(g)![]() 2NO2(g)�ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK= �������¶ȣ�Kֵ (���������С�����䡱)��
2NO2(g)�ﵽƽ��״̬����д����k1����k1����k2����k2����ʾ��ƽ�ⳣ������ʽK= �������¶ȣ�Kֵ (���������С�����䡱)��
��2������2NO(g)+O2(g)![]() 2NO2(g)���ʵ��Ƿ�Ӧ������Ӧ���Ļ��E1�뷴Ӧ���Ļ��E2�Ĵ�С��ϵΪE1 E2(�>������<����=��)���������ʷ��̷����������¶ȸ÷�Ӧ���ʼ�С��ԭ���� ��
2NO2(g)���ʵ��Ƿ�Ӧ������Ӧ���Ļ��E1�뷴Ӧ���Ļ��E2�Ĵ�С��ϵΪE1 E2(�>������<����=��)���������ʷ��̷����������¶ȸ÷�Ӧ���ʼ�С��ԭ���� ��
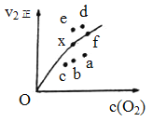
A��k2������c(N2O2)����
B��k2����С��c(N2O2)��С
C��k2������c(N2O2)��С
D��k2������c(N2O2)����
��ʵ�����ݵõ�v2��~[O2]�Ĺ�ϵ������ͼ��ʾ����x�����ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬���Ϊ��Ӧ�ĵ�Ϊ (����ĸ)��
��3����ҵ�Ͽ��ð�ˮ��ΪNO2�����ռ���NO2ͨ�백ˮ�����ķ�Ӧ��2NO2+2NH3��H2O=NH4NO3+NH4NO2+H2O������Ӧ�����Һ������ȳʺ�ɫ����Ӧ����Һ��c(NH4+) c(NO3-)+c(NO2-)(�>����<����=��)����ҵ��Ҳ���õ�ⷨ���������������Ⱦ��������ͼ��ʾ�������缫�����������������մɣ���һ�������¿ɴ���O2-��
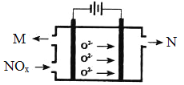
�õ��������ĵ缫��Ӧʽ�� ����������������N�Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com