
| A. | Na+<Mg2+<Al3+<O2- | B. | S2->Cl->Na+>Al3+ | ||
| C. | Na<Mg<Al<S | D. | Cs<Rb<K<Na |
分析 微粒半径大小一般原则:电子层数不同,电子层数越多,半径越大;
电子层数相同的,质子数越多半径越小;
核外电子数相同的,质子数越多半径越小;据此解答.
解答 解:A、Na+、Mg2+、Al3+、O2-四种微粒都是两个电子层,核电荷数越多,半径越小,所以粒子半径Al3+<Mg2+<Na+<O2-,故A错误;
B、S2-、Cl-三个电子层,Na+、Al3+都是两个电子层,电子层越多,半径越大,核电荷数越多,半径越小,所以离子半径:S2->Cl->Na+>Al3+,故B正确;
C、电子层一样,核电荷数越多,半径越小,所以Na>Mg>Al>S,故C错误;
D、电子层越多,半径越大,所以Cs>Rb>K>Na,故D错误.
故选B.
点评 本题考查微粒半径比较,题目难度中等,为元素周期律中常考查知识点,学习中注意积累相关比较方法,注重元素周期律递变规律的应用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
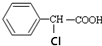 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )| A. | 6种 | B. | 9种 | C. | 15种 | D. | 19种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加盐酸时,HCl是还原剂,Cl2是还原产物 | |
| B. | 已知Bi为第ⅤA族元素,上述实验说明Bi具有较强的非金属性 | |
| C. | 若有0.1 mol NaBiO3参加了反应,则整个过程转移电子0.8 NA | |
| D. | 此实验条件下,物质的氧化性:NaBiO3>KMnO4>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
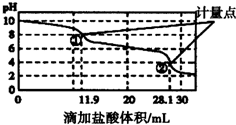
| A. | 此样品n(NaHCO3)=(28.1-11.9)×10-4mol | |
| B. | 计量点②溶液中大量存在的阴离子是Cl- | |
| C. | 计量点①-②之间发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ | |
| D. | 使用该方法测定Na2CO3和NaOH混合溶液中的NaOH含量,将会得到1个计量点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol-OH中含有10 NA个电子 | |
| B. | 1 L 1 mol•L-1CH3COONa溶液中含有NA个CH3COO- | |
| C. | 28g晶体硅中含有共价键数目为2NA个 | |
| D. | 常温常压下11.2 L甲烷气体含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
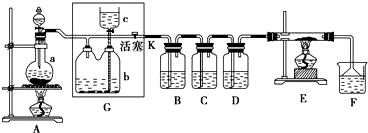
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com