
分析 A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体,常见气体有CO2、SO2,则可知A为C元素,B为O元素,D为S元素;A、C同主族,C与NaOH溶液反应可产生氢气,则C为Si;E的单质可与NaOH溶液反应,E的原子序数大于硫,则E为Cl,据此解答.
解答 解:A、B、C、D、E五种短周期元素的原子序数依次增大,A、B同周期,化合物AB2、DB2均是可使澄清石灰水变浑浊的气体,常见气体有CO2、SO2,则可知A为C元素,B为O元素,D为S元素;A、C同主族,C与NaOH溶液反应可产生氢气,则C为Si;E的单质可与NaOH溶液反应,E的原子序数大于硫,则E为Cl.
(1)由上述分析可知,A为碳,B为氧,C为硅,D为硫,E为氯,故答案为:碳;氧;硅;硫;氯;
(2)SO2使澄清石灰水变浑浊的化学方程式:SO2+Ca(OH)2=CaSO3↓+H2O,故答案为:SO2+Ca(OH)2=CaSO3↓+H2O;
(3)C单质与氢氧化钠溶液反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,E单质与NaOH溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Si+2OH-+H2O=SiO32-+2H2↑;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查元素化合物推断,注意从使澄清石灰水变浑浊的气体入手进行推断,难度不大,侧重化学用语的考查.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案科目:高中化学 来源: 题型:解答题
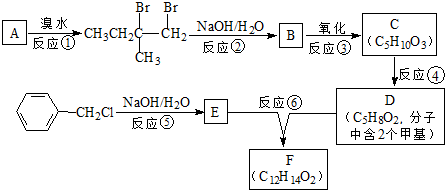
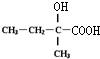
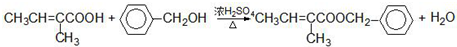 .
. :
: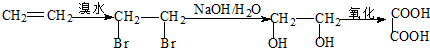 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论或解释 |
| A | 用pH计或pH试纸分别测定饱和SO2水溶液和饱和CO2水溶液的pH值 | 饱和SO2水溶液的pH值小于饱和CO2水溶液 | 亚硫酸强于碳酸 |
| B | 向加热KClO3制氧气后的残余固体中加入浓H2SO4,继续加热 | 产生黄绿色气体 | 浓硫酸与残渣中的KCl发生反应生成了Cl2 |
| C | 加热装在试管中的NH4Cl晶体 | 试管底部的晶体消失,试管上部有晶体凝结. | NH4Cl晶体发生了升华. |
| D | 将一根较粗的铜丝在酒精灯火焰上加热到红热,然后趁热插入乙醇中一会儿取出. | 铜丝先变黑后又变红,乙醇中伴有刺激性气味产生. | 铜丝发生了几个反应,但铜丝前后的质量不变. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $\stackrel{NaNO_{2}}{→}$
$\stackrel{NaNO_{2}}{→}$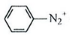


 .
. .D→E的反应类型是氧化反应.
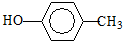
.D→E的反应类型是氧化反应. )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3溶液发生显色反应,这样的结构有3种,写出一种X可能的结构简式 (邻、间、对位置均可).
(邻、间、对位置均可).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题:
氮及其化合物在工业生产和国防建设中有广泛应用.回答下列问题: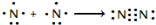 .
.| 化学键 | N-H | N-N | N=N | N≡N | O=O | O-H |
| 键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,测得Na2CO3溶液的pH大于相同物质的量浓度的Na2SO3溶液,说明非金属性:C<S | |
| B. | 绝热容器中,向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| C. | 相同温度时,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| D. | 有HX和HY两种弱酸且酸性HX>HY,则物质的量浓度相同的NaX和NaY两溶液等体积混合的溶液中有 c(X-)>c(Y-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
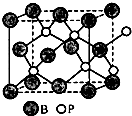 X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.
X、Y、Z、W、A五种元素,均位于周期表的前四周期,它们的核电荷数依次增加,且核电荷数之和为57.Y原子的L层p轨道中有2个电子,Z的原子核外有三个未成对电子,W与Y原子的价电子数相同,A原子的最外层电子数是最内层电子数的一半,其d轨道处于全充满状态.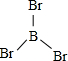 .
.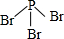 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
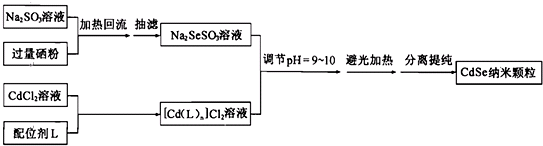

| A. | 在分离提纯CdSe时一般向溶液中加入丙酮,以增强溶剂极性,有利于CeSe的沉淀,提高收率 | |
| B. | 一般可用NaOH调节Na2SeSO3溶液的pH值,在此过程中会有HSe-和HSO3-生成 | |
| C. | 该纳米颗粒不能使用常压过滤或者减压过滤分离,因为其易在滤纸表面形成一层致密而厚实的膜,阻碍溶剂的通过 | |
| D. | 改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒;且若要在60℃得到3.0 nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+<Mg2+<Al3+<O2- | B. | S2->Cl->Na+>Al3+ | ||
| C. | Na<Mg<Al<S | D. | Cs<Rb<K<Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com