



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na2CO3��NaHCO3�ȶ� |
| B��ͬһ�¶��£����Ũ�ȵ����ᷴӦ������CO2��NaHCO3��Na2CO3���� |
| C����ͬ���ᷴӦ���ɵ�����CO2ʱ�������ĵ��������� |
| D��Na2CO3��NaHCO3���������ʯ��ˮ��Ӧ�õ���ɫ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
| A��V1=V3��V2 | B��V2��V1 =V3 | C��V1= V2��V3�� | D��V1��V3��V2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ͨ�����ȵ�CuO��ĩ | B��������̼ͨ��Na2O2��ĩ |
| C������Fe2O3�������ȷ�Ӧ | D����п��Ͷ��Cu(NO3)2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��5molFe��4molCl2��Ӧ��5Cl2+4Fe��ȼ2FeCl2+2FeCl3 |
| B��2molKMnO4��3molH2O2�����������·�Ӧ��2MnO4��+3H2O2+6H+��Mn2��+4O2��+6H2O |
| C���ڵ��ҺΪ�������صļ״�ȼ�ϵ���ڵ�·�У������ĵ缫��ӦʽΪ��CH3OH��6e��+8OH����CO32��+6H2O |
| D����NaAlO2��Һ��ͨ�����CO2��CO2+3H2O+2AlO2����2Al(OH)3��+CO32�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
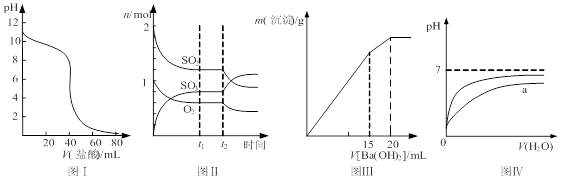
| A��ͼ���ʾ����μӵ�0.1 mol/Lij����Һ�õ��ĵζ����ߣ�����֪Ũ������ζ�δ֪Ũ�ȸü�ʱ���ѡȡ��̪��ָʾ�� |
B��ͼ���ʾһ�������½��еķ�Ӧ2SO2��O2 2SO3 ���ɷֵ����ʵ����仯��t2ʱ�̸ı��������������С������� 2SO3 ���ɷֵ����ʵ����仯��t2ʱ�̸ı��������������С������� |
| C��ͼ���ʾij������Һ�м���Ba(OH)2��Һ�����������������Ba(OH)2��Һ����Ĺ�ϵ���ڼ���20 mL Ba(OH)2��Һʱ������ǡ�ó�����ȫ |
| D��ͼ����ʾpH��ͬ������������зֱ����ˮ����ҺpH�ı仯����������a��Ӧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��x��2y |
| B��þ���Ͻ������ᷴӦʱת�Ƶ��ӵ���ĿΪ0.1NA |
| C��þ���Ͻ������ᷴӦ����H2������ڳ��³�ѹ�´���1.12 L |
| D��a��ȡֵ��ΧΪ0.9 g��a��1.2 g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ס����ж��������� | B�����������������м���� |
| C����������������������� | D������������������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com