
����Ŀ�����������£��赥�ʺ�HCl��Ӧ����SiHCl3�Ǵֹ��ᴿ����Ҫ���裮ijС�������ͼ��ʾװ���������ת�����г�װ����ȥ���� 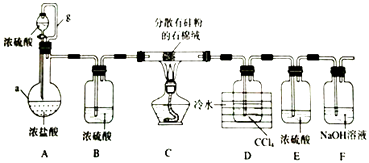
��֪��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������CCl4�ķе�Ϊ76.8��C��
��ش�
��1������a������������g��������
��2��װ��A�У�Ũ�������ֵ�����Ϊ��ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ���������
��3��װ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��
��4��װ��D�����õ�Һ̬�����ķ��뷽��Ϊ �� ����������ƣ�
��5����Ӧ�������ͨ��װ��F�е�NaOH��Һ���ݳ�����Ĵ�������Ϊ��
��6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ���������һ�������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1��������ƿ��ƽ��ѹǿ��ʹŨ�������μӣ������������𰸣�
��2����ˮ�ԣ��ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2����
��3��Si+3HCl ![]() SiHCl3+H2
SiHCl3+H2
��4������
��5����ȼ���������ռ���
��6��2SiHCl3+O2+2H2O�T2SiO2+6HCl
���������⣺��1������a�Ǿ���֧�ܵ���ƿ��Ϊ������ƿ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã�ʹ��Һ©���е�Һ��Ũ����˳�����£��ʴ�Ϊ��������ƿ��ƽ��ѹǿ��ʹŨ�������μӣ������������𰸣�����2��װ��A��������ƿ��ʢ��Ũ���ᣬ��Һ©����ʢ��Ũ���ᣬ����Ũ�������ˮ���Լ��Ȼ���Ļӷ��ԣ���Һ©����������A���ų��Ȼ������壬SiHCl3�ķе�Ϊ33.0��C���������л��ܼ�������ˮ���ҷ�Ӧ���ڿ������ױ�������ʵ��ʱ�����ȴ�Һ©��������һ��ʱ����ڵ�ȼC���ƾ��ƣ��ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2������
�ʴ�Ϊ����ˮ�ԣ� �ž�װ���еĿ���������SiHCl3������е�ˮ������Ӧ�ͱ�O2��������3�����������Ϣ���赥�ʺ�HCl��Ӧ����SiHCl3��֪������Ȼ��ⷴӦ�ķ���ʽΪ��Si+3HCl ![]() SiHCl3+H2 ��
SiHCl3+H2 ��
�ʴ�Ϊ��Si+3HCl ![]() SiHCl3+H2����4��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ����Ƴ���SiHCl3���ܲ������ᴿSiHCl3�ķ�����������е�ϵͣ�ͨ������ķ�������õ�������SiHCl3 ��
SiHCl3+H2����4��SiHCl3�ķе�Ϊ33.0��C���������л��ܼ����Ƴ���SiHCl3���ܲ������ᴿSiHCl3�ķ�����������е�ϵͣ�ͨ������ķ�������õ�������SiHCl3 ��
�ʴ�Ϊ������5���赥�ʺ�HCl��ӦSi+3HCl ![]() SiHCl3+H2 �� �ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl
SiHCl3+H2 �� �ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬ͨ��װ��F��ʣ������Ϊ����������ȼ������ˮ����ͨ����ȼ�������ռ�������
SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬ͨ��װ��F��ʣ������Ϊ����������ȼ������ˮ����ͨ����ȼ�������ռ�������
�ʴ�Ϊ����ȼ���������ռ�������6������ȶ�������Ϊ�������裬SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬����ԭ���غ��֪һ��������Ϊ�Ȼ��⣬���Ը÷�Ӧ�Ļ�ѧ����ʽΪ��2SiHCl3+O2+2H2O�T2SiO2+6HCl��
�ʴ�Ϊ��2SiHCl3+O2+2H2O�T2SiO2+6HCl��
�ֹ��ᴿ��װ��A��������ƿ��ʢ��Ũ���ᣬ��Һ©����ʢ��Ũ���ᣬ����Ũ�������ˮ���Լ��Ȼ���Ļӷ��ԣ���Һ©����������A���ų��Ȼ������壬�ž�װ���еĿ�����װ��B�����Ȼ���������и��װ��C���ֹ������HCl���巴Ӧ�Ƶ�SiHCl3��Si+3HCl ![]() SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬װ��E��ֹF�е�ˮ��������װ��D��SiHCl3������Ӧ��װ��D�ռ�SiHCl3 �� ͨ��װ��F��ʣ������Ϊ��������ͨ����ȼ�������ռ������� ��1����������a�������Լ��������������ƽ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã���2��Ũ���������ˮ�ԣ��Ȼ����ӷ���SiHCl3����ˮ���ҷ�Ӧ���ڿ������ױ���������3������Ȼ����ڼ��ȵ������·�Ӧ���ɺ����ȹ������������4���õ��IJ���е㲻ͬ�����Կ��Ʒе�ͨ������ķ����õ�SiHCl3����5����Ӧ�������Ϊ�������������пɿ�ȼ�ԣ���ͨ��ȼ�ջ������ռ��ķ�������β������6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬һ�����������ԭ���غ��֪Ϊ�Ȼ��⣮
SiHCl3+H2��װ��F�е�����������Ϊ�����չ������Ȼ��⣬װ��E��ֹF�е�ˮ��������װ��D��SiHCl3������Ӧ��װ��D�ռ�SiHCl3 �� ͨ��װ��F��ʣ������Ϊ��������ͨ����ȼ�������ռ������� ��1����������a�������Լ��������������ƽ��װ��A�е�b������Ϊ��ƽ��ѹǿ�����ã���2��Ũ���������ˮ�ԣ��Ȼ����ӷ���SiHCl3����ˮ���ҷ�Ӧ���ڿ������ױ���������3������Ȼ����ڼ��ȵ������·�Ӧ���ɺ����ȹ������������4���õ��IJ���е㲻ͬ�����Կ��Ʒе�ͨ������ķ����õ�SiHCl3����5����Ӧ�������Ϊ�������������пɿ�ȼ�ԣ���ͨ��ȼ�ջ������ռ��ķ�������β������6��SiHCl3�ڳ�ʪ�Ŀ����б�����������һ��������Ϊ�������裬һ�����������ԭ���غ��֪Ϊ�Ȼ��⣮


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ����������NaHCO3��ĩ����һ�ݼ����������ᣬ�ڶ����ȼ���ʹ����ȫ�ֽ��ټ�����ͬ�������������ᣬ�����������ĵ��������Ȼ����������Ϊ��������
A.2��1
B.1��1
C.1��2
D.3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������װ�ã��ӳ�װ����ȥ���ܴﵽ����Ŀ���ǣ� ��
ѡ�� | A | B | C | D |
װ�� |
|
|
|
|
ʵ��Ŀ�� | �ȽϷǽ����ԣ�N��C��Si | �Ʊ����ռ��������� | ��ȥCa��OH��2�е�NH4Cl | ��֤HCl���ܽ��� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨHNO3����һԪ���ᣬ�����ἰ������ʵ���ҵ����������ҪӦ�ã���ش�
��1��HNO3�ĵ��볣��Ka�ı���ʽΪ ��
��2�����������£�K2Cr2O7�ܱ�NaNO2��ԭΪCr3+ �� �÷�Ӧ�����ӷ���ʽΪ ��
��3��25��ʱ����0.100molL��1NaOH��Һ�ζ�20.0mLijŨ�ȵ�HNO3��Һ����Һ��pH��NaOH��Һ�����V���Ĺ�ϵ��ͼ��ʾ�� 
��֪��M���Ӧ��Һ�У�c��OH����=c��H+��+c��HNO2������
��ԭ��Һ��c��HNO2��Ϊ��������λ��Ч���֣���
�����й���N���Ӧ��Һ��˵����ȷ��������ѡ����ĸ����
A����Һֻ��NaNO2
B��ˮ���������c��H+��=1��10��7 molL��1
C����Һ������Ũ�ȣ�c��Na+��=c��NO3����
D����Һ�У�c��Na+����c��OH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ԭ����ʾ�ĵ����Ų��ܼ�˳��ʵ���Ǹ��ܼ������ߵ͡�����E(nl)��ʾij�ܼ������������¸�ʽ����ȷ����( )
A. E(5s)>E(4f)>E(4s)>E(3d)
B. E(3d)>E(4s)>E(3p)>E(3s)
C. E(4s)<E(3s)<E(2s)<E(1s)
D. E(5s)>E(4s)>E(4f)>E(3d)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���������Fe�ۺ�Cu�۵Ļ�����Ʊ�CuSO45H2O��FeSO4��NH4��2SO46H2O�Ĺ���������ͼ1��ʾ��
��֪���ټ������ʵ��ܽ�ȣ�g/100gH2O�������ʾ��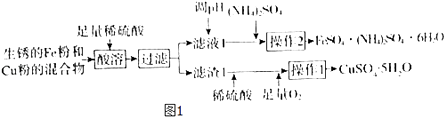
FeSO47H2O | ��NH4��2SO4 | FeSO4��NH4��2SO46H2O | |
20�� | 48 | 75 | 37 |
60�� | 101 | 88 | 38 |
����ҺpH��4ʱ��Fe2+���ױ�������
��ش�
��1���������õ���Ҫ��������Ϊ ��
��2����Һ1�е���Ҫ����Ϊ���ѧʽ����
��3�����в���2ʱ������Һ���������������ȹ��ˣ�ԭ��Ϊ ��
��4��FeSO4��NH4��2SO46H2O������ϡ����ϴ�ӣ���������ˮϴ�ӵ�ԭ��Ϊ ��
��5����ȡ2.50gCuSO45H2O��Ʒ�����չ�������Ʒ�������¶ȣ�T���仯��������ͼ2��ʾ�� 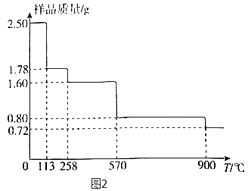
��120�����Ĺ��壬����������258��ʱʧˮ����������Ӧ�Ļ�ѧ����ʽΪ ��
��900��ʱʣ�����ֻ��һ��ͭ��������仯ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����������ˮʹ�ã����з�����ԭ������ȫ�����е���
A. ����̫����ʹ��ˮ����
B. ������ʹ��ˮ�е��ηֳ���������
C. ���õ����������Ի�ȡ����������ˮ
D. ����ˮͨ�����ӽ�����֬���Գ�ȥ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ס��ҡ�����X����ѧ��ѧ�����ֳ��������ʣ���ת����ϵ��ͼ��ʾ�����X�������ǣ� �� 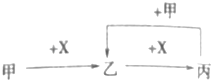
A.��ΪCO2 �� XΪNaOH��Һ
B.��ΪNH3 �� XΪO2
C.��ΪSi��XΪO2
D.��ΪNaAlO2 �� XΪHCl��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пһ����ȼ�ϵ�ؿ����綯��������Դ���������ҺΪKOH����ӦΪ2Zn+O2+2H2O+4OH��=2Zn��OH��42�� �� ����˵����ȷ���ǣ� ��
A.�ŵ�ʱ���������Һ��K+����
B.�ŵ�ʱ���������Һ��pH ����
C.���ʱ�������ķ�ӦΪ��Zn��OH��42��+2e��=Zn+4OH��
D.���ʱ������4.48L ��������״���£��ͷų���ʱ������������ZnΪ13g
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com