
【题目】工业上用生锈的Fe粉和Cu粉的混合物制备CuSO45H2O和FeSO4(NH4)2SO46H2O的工艺流程如图1所示.
已知:①几种物质的溶解度(g/100gH2O)如表所示.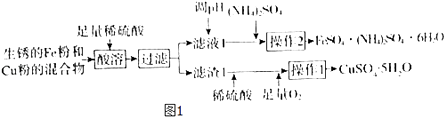
FeSO47H2O | (NH4)2SO4 | FeSO4(NH4)2SO46H2O | |
20℃ | 48 | 75 | 37 |
60℃ | 101 | 88 | 38 |
②溶液pH>4时,Fe2+容易被氧化.
请回答:
(1)过滤所用的主要玻璃仪器为 .
(2)溶液1中的主要溶质为(填化学式).
(3)进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为 .
(4)FeSO4(NH4)2SO46H2O用适量稀硫酸洗涤,而不是用水洗涤的原因为 .
(5)称取2.50gCuSO45H2O样品,灼烧过程中样品质量随温度(T)变化的曲线如图2所示. 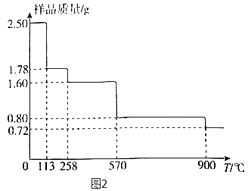
①120℃所的固体,继续加热至258℃时失水,所发生反应的化学方程式为 .
②900℃时剩余固体只有一种铜的氧化物,其化学式为 .
【答案】
(1)玻璃棒、漏斗、烧杯
(2)FeSO4、H2SO4
(3)减小硫酸亚铁和硫酸铵的析出使得FeSO4?(NH4)2SO4?6H2O晶体更纯
(4)抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化
(5)CuSO4?H2O ![]() CuSO4+H2O;Cu2O
CuSO4+H2O;Cu2O
【解析】解:流程分析可知生锈的Fe粉和Cu粉的混合物,加入足量和稀硫酸得硫酸亚铁溶液及铜固体,过滤得滤渣1为铜,滤液1为硫酸亚铁和稀硫酸混合溶液,在铜中再加硫酸同时通入氧气氧化铜得硫酸铜溶液,经蒸浓缩、降温结晶可得硫酸晶体,滤液1经调节PH值,再加入硫酸铵,经蒸发浓缩,趁热过滤可得FeSO4(NH4)2SO46H2O晶体,同时可减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯,再经适量稀硫酸洗涤干燥得较纯的FeSO4(NH4)2SO46H2O晶体,(1)过滤所用的主要玻璃仪器为玻璃棒、漏斗、烧杯,所以答案是:;(2)根据上面分析可知,溶液1中的主要溶质为FeSO4、H2SO4 ,
所以答案是:FeSO4、H2SO4;(3)根据题中提供的溶解度数据可知,进行操作2时,从溶液中析出晶体后,需趁热过滤,原因为减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯,
所以答案是:减小硫酸亚铁和硫酸铵的析出使得FeSO4(NH4)2SO46H2O晶体更纯;(4)FeSO4(NH4)2SO46H2O用适量稀硫酸洗涤,抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化,
所以答案是:抑制亚铁离子和铵根离子的水解,防止亚铁离子被氧化;(5)①设 CuSO45H2O分解的方程式为
CuSO45H2O |
| CuSO4(5﹣x)H2O+ | xH2O |
250 | 18x | ||
2.5 | 2.5﹣1.78 |
解得x=4,对应固体的化学式为CuSO4H2O,同理可推知,1.60g对应固体的化学式为CuSO4 , 所以发生反应的化学方程式为CuSO4H2O ![]() CuSO4+H2O,
CuSO4+H2O,
所以答案是:CuSO4H2O ![]() CuSO4+H2O;
CuSO4+H2O;
②2.50gCuSO45H2O样品中铜元素的物质的量为0.01mol,根据铜元素守恒可知,900℃时剩余固体只有一种铜的氧化物中铜元素也为0.01mol,而此时固体的质量为0.72g,所以氧化物中氧元素的物质的量为 ![]() mol=0.005mol,所以该铜的氧化物的化学式为 Cu2O,
mol=0.005mol,所以该铜的氧化物的化学式为 Cu2O,
故答案:Cu2O.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)甲酸与新制氢氧化铜悬浊液受热:;
(2)乙二酸和乙二醇酯化成环:;
(3)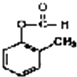 发生银镜反应的化学方程式:;
发生银镜反应的化学方程式:;
(4)丙烯酸甲酯(CH2=CHCOOCH3)加聚反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖尿病是一种常见病,发病率有逐年增加的趋势,且目前还没有根治的方法,下列叙述不正确的是( )
A.正常人的尿液中不含葡萄糖,只有糖尿病人才会出现糖尿
B.糖尿病的基因治疗是运用基因工程技术切除缺陷基因,从而达到治疗疾病的目的
C.凡是有甜味的食物都含有葡萄糖
D.医疗上用新制Cu(OH)2悬浊液来测定患者尿中葡萄糖的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氨的叙述中,正确的是
①氨气极易溶于水,可以用来做喷泉实验 ②可用湿润的蓝色石蕊试纸检验氨气 ③可用向上排空气法收集氨气 ④氨易液化,工业上可用氨作制冷剂 ⑤实验室制得氨气用碱石灰干燥
A. ①②③B. ②③④C. ③④⑤D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热条件下,硅单质和HCl反应生成SiHCl3是粗硅提纯的重要步骤.某小组设计如图所示装置完成上述转化(夹持装置略去). 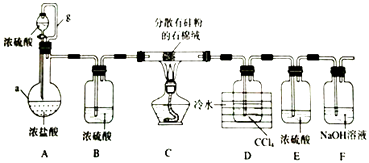
已知:SiHCl3的沸点为33.0°C,易溶于有机溶剂,能与水剧烈反应,在空气中易被氧化,CCl4的沸点为76.8°C.
请回答:
(1)仪器a的名称为;导管g的作用为;
(2)装置A中,浓硫酸体现的性质为;实验时,需先打开分液漏斗活塞,一段时间后,在点燃C处酒精灯,理由是;
(3)装置C中发生反应的化学方程式为;
(4)装置D中所得的液态混合物的分离方法为 . (填操作名称)
(5)反应后的气体通过装置F中的NaOH溶液后,对逸出气体的处理方法为;
(6)SiHCl3在潮湿的空气中被氧化,生成一种氧化物和一种无氧酸,该反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年3月10日,中科院上海光机所强场激光物理重点实验室宣布,其利用超强短激光成功产生反物质,这是我国科学家首次利用激光成功产生反物质.物质和反物质是对称的,反物质是由反粒子构成,反粒子的质量、寿命、自旋等与粒子完全相同,但所带电荷的电性相反.如果用反质子和反中子代替原子核中的质子和中子,就得到反原子核,再配以正电子,就形成反原子,反原子构成反分子,进而构成反物质.下列选项错误的是( )
A.氢原子的结构示意图为: ![]() ;则反氢原子的结构示意图为:
;则反氢原子的结构示意图为: ![]()
B.反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子
C.反氢原子的摩尔质量为1g/mol
D.21H的反氢原子中有2个带负电荷的反质子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,①~⑦均为中学化学常用的实验装置. 
(1)若用图①装置制备氨气,写出化学方程式 .
(2)利用图②装置,在实验室可制备下列哪些气体(填字母代号).
a.C2H4 b.NO2 c.H2 d.Cl2 e.CO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域.用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素.反应的方程式为:CO(NH2)2+H2O2 ![]() CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
CO(NH2)2H2O2 . 过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程(如图1)及反应装置图2:
请回答下列问题:
(1)仪器X的名称是;冷凝管中冷却水从(填“a”或“b”)口进入;
(2)反应器的加热方式是 .
(3)搅拌器是否可用铁质材料(填“是”或“否”),原因是;
(4)步骤①采用减压蒸发的原因是 .
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素,可采用的操作是 .
A.盐析、过滤
B.减压蒸馏、结晶
C.分液、过滤
D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL 6molL﹣1 H2SO4 , 用0.1000molL﹣1 KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2H2O2的质量分数为;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量(填“偏高”、“偏低”或“不变”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com