
| |||||||||||||||||||||||||||
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2011-2012学年吉林省长春市高三第一次调研测试化学试卷 题型:实验题
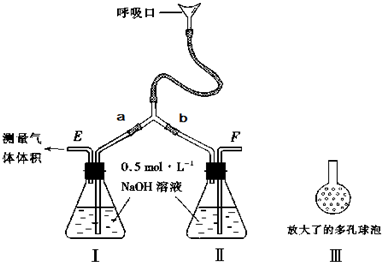
(9分)为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空:

⑴图中瓶II的作用是______________________________。
⑵对实验装置尚有如下A、B、C、D四种观点,你认为合理的是________。(填代号)
A.在E处增加CaCl2干燥管 B.在F处增加CaCl2燥管
C.在E和F两处增加CaCl2干燥管 D.不必增加干燥管
⑶将插入溶液的管子末端改成具有多孔的球泡(图中的III),有利于提高实验的准确度,
其理由是__________________________________________。
⑷实验时先缓缓吸气,再缓缓呼气,反复若干次,得如下数据:瓶I溶液增重ag,收集到的气
体体积(标准状况)为bL,该呼出气体中CO2的体积分数是(列出算式) ___________。
⑸为防止实验中若猛吸猛呼,会造成不安全后果,将实验装置如何改进 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某校课外兴趣小组用如图装置进行电解CuC12溶液的实验。实验时,在通电一段时间后,观察到阳极上方的淀粉KI试纸不变色,同时,铁棒逐渐溶解;阴极碳棒上有红、白两种颜色的固体析出。同学们对阴、阳两极的产物进行如下探究:
 (1)阳极产物探究。
(1)阳极产物探究。
根据实验现象,同学们对阳极发生的电极反应提出了如下假设:
假设1 Fe-3e == Fe3+ ;
假设2 。
请你设计实验方案证明你的假设(包括:操作→现象→结论)
(2)阴极产物探究:
| 查阅资料 | 铜和铜的化合物中Cu、Cu2O为红色,CuCl、CuBr、CuI为白色,它们在水中均不溶,且稳定存在。 |
| 探究实验 | 取出阴极碳棒,并将其干燥,然后用如图所示装置(气密性良好,药品性能良好)进行实验并记录现象: 现象:碳棒上红色物质依然存在;白色物质变为红色;无水硫酸铜仍为白色;蓝色石蕊试纸变为红色 |
结论与解释:
①白色物质为 。
②某学生收集碳棒上的白色物质并装入试管中,滴人稀HNO3,写出白色物质与稀HNO3反应的离子方程式: 。(不需要配平)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com