
【题目】《科学美国人》评近三年十大创新技术之一是碳呼吸电池,电池装置如下图所示,下列说法正确的是
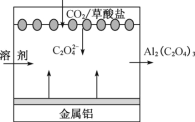
A. 金属铝作正极 B. 负极发生了还原反应
C. 利用该技术可捕捉大气中的CO2 D. 该电池工作时电能转变为化学能
科目:高中化学 来源: 题型:
【题目】科学家开发出一种低成本光伏材料—蜂窝状石墨烯。生产原理是Na2O+2CO  Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
Na2CO3+C(石墨烯),然后除去Na2CO3,即可制得蜂窝状石墨烯。下列说法不正确的是( )
A.该生产石墨烯的反应属于氧化还原反应
B.石墨烯与金刚石互为同素异形体
C.Na2O属于碱性氧化物,CO属于酸性氧化物,Na2CO3属于盐
D.自然界中钠元素以化合态形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液与草酸溶液的反应来测定血钙的含量。
(1)配平以下离子方程式,并在□中填上合适的微粒:
________![]() ________
________![]() ________
________![]() ________
________![]() ________
________![]() ________________
________________
(2)测定血钙的含量:取2 mL血液用蒸馏水稀释后,向其中加入足量![]() 溶液,反应生成
溶液,反应生成![]() 沉淀,过滤并洗涤沉淀,将沉淀用稀硫酸溶解得到
沉淀,过滤并洗涤沉淀,将沉淀用稀硫酸溶解得到![]() 后,再与一定量的
后,再与一定量的![]() 溶液恰好完全反应。溶解沉淀时________(填“能”或“不能”)使用稀盐酸,原因是____________。
溶液恰好完全反应。溶解沉淀时________(填“能”或“不能”)使用稀盐酸,原因是____________。
(3)若消耗了![]() 的
的![]() 溶液40.00 mL,则100 mL该血液中含钙________g。
溶液40.00 mL,则100 mL该血液中含钙________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
①漂白粉、水玻璃、福尔马林都是混合物
②砹(At)是第ⅦA族,AgAt 易溶于水
③用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
④Cs2CO3加热时不能分解为CO2和Cs2O
⑤纳米铁粉可以除被污染水体中的重金属离子
⑥根据反应SiO2+CaCO3![]() CaSiO3+CO2↑可推知硅酸酸性比碳酸强
CaSiO3+CO2↑可推知硅酸酸性比碳酸强
A. ①③④⑤ B. ①④⑤ C. ③④⑤⑦ D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作或现象描述正确的是( )

A. 实验室用图1装置制备Cl2
B. 加热后图2中溶液颜色恢复红色
C. 用图3装置除去Cl2中含有的少量HCl
D. 实验室用图4装置制取少量蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于四大基本反应类型,但属于氧化还原反应的是
A. 2Na+2H2O===2NaOH+H2↑
B. Cl2+H2O===HCl+HClO
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. Ca(ClO)2+2HCl===CaCl2+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应3Cu +8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ +4H2O 中
(1)用单线桥标出电子转移___________________________
(2)还原剂是__________,被还原的元素是__________,还原产物是__________。
(3)若生成2mol的NO气体,溶液中生成的Cu2+为___________mol。
(4)在反应中硝酸显示_________性和____________性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有足量A的容积固定的密闭容器中加入B,发生反应:A(s)+2B(g) 4C(g)+D(g) ΔH<0。一定条件下达到平衡时,C的物质的量与加入的B的物质的量的关系如图所示。其他条件不变,下列措施能使θ值增大的是( )

A. 降低温度B. 增大压强C. 加入催化剂D. 再加入少量A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
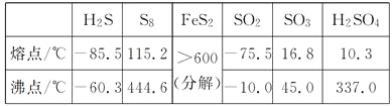
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为____________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________。
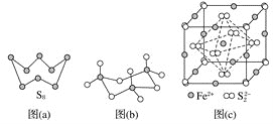
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为anm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______________________________g·cm-3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为________nm。
所形成的正八面体的体心,该正八面体的边长为________nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com