

 故答案为:1s22s22p2;
故答案为:1s22s22p2;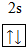
 ;
;

科目:高中化学 来源: 题型:

| A、该有机物与浓溴水可发生取代反应 |
| B、1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH |
| C、该有机物与浓硫酸混合共热可发生消去反应 |
| D、该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
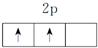
 甲、乙、丙、丁、戊五种元素,其中甲元素原子核外L层上s能级和p能级电子个数相同;乙元素原子3p能级上只有1对成对电子;丙和丁元素原子N层上都只有1个电子,但其中丙元素原子各内层均已充满;而丁元素原子次外层的电子充满在2个能级中;戊元素单质常温时为气态,原子最外层电子排布图如图所示:试回答以下问题.
甲、乙、丙、丁、戊五种元素,其中甲元素原子核外L层上s能级和p能级电子个数相同;乙元素原子3p能级上只有1对成对电子;丙和丁元素原子N层上都只有1个电子,但其中丙元素原子各内层均已充满;而丁元素原子次外层的电子充满在2个能级中;戊元素单质常温时为气态,原子最外层电子排布图如图所示:试回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色,苯和溴水发生取代反应,使溴水褪色 |
| B | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 | 除去MgCl2溶液中少量FeCl3 |
| C | 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液 | 有白色沉淀产生,蛋白质发生了变性 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得气体是否为乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属的活动性 |
| B、金属的导电性 |
| C、金属的延展性 |
| D、地壳中金属元素的含量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com