
【题目】设计实验探究乙烯与溴的加成反应。已知制取乙烯的化学方程式为CH3CH2OH![]() CH2=CH2↑+H2O。
CH2=CH2↑+H2O。
(1)甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溴水褪色,即证明乙烯与溴水发生了加成反应。甲同学设计的实验__(填“能”或“不能”)验证乙烯与溴水发生了加成反应,其理由是_______(填编号)。
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的气体,未必是乙烯
D.使溴水褪色的气体,就是乙烯
(2)乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量有还原性的杂质气体,由此他提出必须先把杂质气体除去,再与溴水反应。乙同学推测此乙烯中可能含有的一种杂质气体是_____,它与溴水发生反应的化学方程式是________,在验证过程中必须全部除去。
(3)为了验证乙烯与溴水的反应是加成反应而不是取代反应,可采取哪些方法____?
【答案】不能 AC SO2 SO2+Br2+2H2O=2HBr+H2SO4 向反应后的溶液中滴加石蕊溶液,溶液不变红,说明该反应为加成反应而非取代反应
【解析】
用此法得到的乙烯内可能含有SO2气体,因SO2能将溴水还原而使之褪色,因此溴水褪色不能证明是乙烯与溴水发生了加成反应;乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性。
(1)乙醇和浓硫酸作原料制取的乙烯中含有二氧化硫等物质,二氧化硫能使溴水褪色,溴水褪色不能证明是乙烯与溴水发生了加成反应;
(2)二氧化硫具有还原性,可被溴氧化生成硫酸;
(3)乙烯若与溴水发生取代,则有HBr生成从而使溶液显酸性,若发生加成反应则生成CH2BrCH2Br溶液不显酸性,据此溶液显酸性设计实验验证。
(1)由于浓硫酸在加热时具有强的氧化性,可以将乙醇氧化,浓硫酸被还原产生SO2,用此法得到的乙烯内可能会混有杂质SO2气体,因SO2具有还原性,溴水具有强的氧化性,SO2能将溴水还原而使之褪色,反应方程式为:SO2+Br2+2H2O=2HBr+H2SO4,因此溴水褪色不能证明是乙烯与溴水发生了加成反应,合理选项是AC;
(2)SO2具有较强的还原性,根据元素守恒和还原性推断,气体只能是SO2,该杂质气体SO2与溴水反应使溴水褪色的方程式为:SO2+Br2+2H2O=2HBr+H2SO4;
(3)乙烯若与溴水发生取代,会有HBr生成从而使溶液显酸性,若发生加成反应,则会生成1,2-二溴乙烷CH2BrCH2Br,溶液不显酸性,所以检验方法为:向反应后的溶液中滴加石蕊试液,溶液不变红,说明该反应为加成反应而非取代反应。


科目:高中化学 来源: 题型:
【题目】金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍。下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 电解后,电解槽底部的阳极泥中只有金属Pt
B. 电解过程中,电解质溶液的质量可能保持不变
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 阳极发生氧化反应,其电极反应式:Ni2++2e-![]() Ni
Ni
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知结合 OH-能力:Al3+>NH4+>Al(OH)3,0.1mol·L-1 NH4Al(SO4)2 溶液与 0.1mol·L-1 Ba(OH)2 溶液混合,离子反应方程式正确的是( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一氧化碳和二氧化碳混合气体的质量为36 g,体积为22.4 L。
(1)混合气体中一氧化碳的体积是__________。
(2)混合气体中二氧化碳的物质的量是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色,化学方程式为N2O4 ![]() 2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
2NO2。下列条件的改变对其反应速率几乎无影响的是 ( )
A. 增加NO2的物质的量 B. 将容器的体积缩小一半
C. 保持体积不变,充入N2使体系压强增大 D. 保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲。电解过程中的实验数据如图乙,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法不正确的是
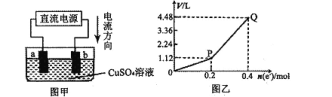
A.电解过程中,a电极表面先有红色物质析出,后有气泡产生
B.b电极上发生的反应方程式为:4OH-一4e-=2H2O+O2↑
C.曲线O一P段表示H2的体积变化
D.Q点时收集到的混合气体中H2和O2体积比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯和乙烷的混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后乙烯和乙烷充分燃烧,得到一氧化碳和二氧化碳的混合气体和45g水。
(1)一氧化碳和二氧化碳的混合气体总物质的量是_____,生成水的物质的量是____。
(2)当a=1时,乙烯和乙烷的物质的量之比是________。
(3)当a=1,且反应后一氧化碳和二氧化碳混合气体的物质的量是反应前氧气的2/3时,则b等于______,得到的一氧化碳和二氧化碳的物质的量之比是_____。
(4)a的取值范围是________,b的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却 ⑨摇动
其正确的操作顺序为__________________。必须用到的玻璃仪器有烧杯、胶头滴管、________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为________ g,要完成本实验该同学应称出________ g NaOH。

(3)使用容量瓶前必须进行的一步操作是________。
(4)如图是该同学转移溶液的示意图,图中有两处错误,请写出:

①________________________________________________________________________
②________________________________________________________________________
(5)在配制过程中,其他操作都是正确的,下列操作会引起误差偏高的是________(填字母)。
A.所用NaOH已经潮解
B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里
D.用带游码的托盘天平称5.4 g NaOH(1 g以下用游码)时误用了“左码右物”方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H2(g)+![]() O2(g)=H2O(g) ΔH1=akJ·mol1
O2(g)=H2O(g) ΔH1=akJ·mol1
②2H2(g)+O2(g)=2H2O(g) ΔH2=bkJ·mol1
③H2(g)+![]() O2(g)=H2O(l) ΔH3=ckJ·mol1
O2(g)=H2O(l) ΔH3=ckJ·mol1
④2H2(g)+O2(g)=2H2O(l) ΔH4=d kJ·mol1
下列关系式中正确的是
A.a<c<0B.b>d>0C.2a=b<0D.2c=d>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com