
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
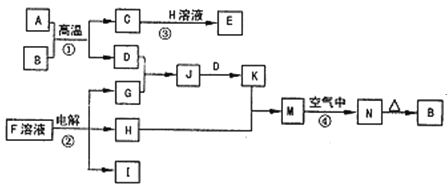
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
【答案】![]() 离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
离子键和共价键 白色沉淀迅速转化为灰绿色,最后变化为红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 1.28×104kJ 阴 13 4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+
【解析】
反应①常被应用于野外焊接钢轨,应为金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+2Al![]() 2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
2Fe+Al2O3,结合N加热生成B分析判断,则A为Al,B为Fe2O3,反应②是工业上重要的反应之一,分析流程图可知,H为溶液和铝热反应生成的C发生反应,说明H为NaOH,C为Al2O3,D为Fe,G为Cl2;J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,N为红褐色固体,应为Fe(OH)3,反应②是电解F溶液应为NaCl溶液,电解生成NaOH、H2和Cl2气体,则D应为Fe,C为Al2O3,H为NaOH,G为Cl2,J为FeCl3溶液,K为FeCl2溶液,M为Fe(OH)2,I为H2;
(1)、分析判断H为NaOH.电子式为:![]() ,氢氧化钠中含有离子键和共价键,故答案为:
,氢氧化钠中含有离子键和共价键,故答案为:![]() ;离子键和共价键;
;离子键和共价键;
(2)、反应④为氢氧化亚铁被空气中的氧气氧化为氢氧化铁的过程,反应现象为白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:白色沉淀迅速转化为灰绿色最后变化为红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)、已知I为H2的燃烧热是-285.8kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则1m3(标准状况)H2物质的量=![]() ,完全燃烧,恢复至室温时放出的热量=
,完全燃烧,恢复至室温时放出的热量=![]() ×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
×285.8kJ/mol=1.28×10-4kJ,故答案为:1.28×10-4kJ;
(4)、25℃时,以Pt为电极电解含有少量酚酞的F为NaCl的饱和溶液,阳极电极反应为2Cl--2e-=Cl2↑,阴极电极反应为2H++2e-=H2↑,阴极负附近氢离子浓度减小,氢氧根离子浓度增大,溶液呈红色;若在此极收集到0.2g气体,即生成氢气物质的量为0.1mol,转移电子为0.1mol,所以溶液中增加氢氧根离子物质的量为0.2mol,溶液体积为2L,溶液中氢氧根离子浓度为0.1mol/L,则此时溶液的pH=13,故答案为:阴;13;
(5)、在K为FeCl2溶液中加入与FeCl2等物质的量的Na2O2,恰好使K转化为N为Fe(OH)3,依据氧化还原反应电子守恒和原子守恒写出反应的离子方程式为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+,故答案为:4Fe2++4Na2O2=4Fe(OH)3↓+O2↑+8Na+。


科目:高中化学 来源: 题型:
【题目】(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。刻蚀印刷电路板涉及的离子方程式为________,检验溶液中还有Fe3+的试剂是_________。
(2)—定量的SO2与NaOH溶液反应,所得产物中含有Na2SO3和NaHSO3,物质的量之比为3:5,则参加反应的SO2与NaOH的物质的量之比为___________。
(3)铝分别与足量的NaOH溶液和稀硫酸反应,若两个反应在相同状况下放出等量的气体,则两个反应中消耗的铝的物质的量之比为_________。
(4)在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中 CO和CO2物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
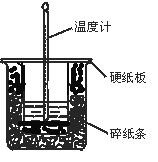
(1)从实验装置上看,图中尚缺少的一种玻璃用品是______________________。
(2)在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________;大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)。
(3)做一次完整的中和热实验,温度计需要使用______次;
(4)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1的NaOH溶液各50 mL。若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容c=4.18 J/(g·℃),反应后温度升高了△t,则生成1mol水时的反应热ΔH=___________ kJ/mol(填表达式)。
(5)如果用50mL0.50mol/L醋酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量______(填“相等、不相等”),简述理由____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组按如下步骤制作紫草手工皂。
Ⅰ.制作紫草油:用50mL菜籽油浸泡15g紫草根30天,倾析法分离出紫草油。
Ⅱ.皂化过程:
①用移液管量取26mL紫草油、10mL95%的乙醇于三颈烧瓶中,40℃水浴加热,装置如图。
②量取20mL30%的氢氧化钠溶液,分多次缓慢加入紫草油中,边加边搅拌。
③皂化反应结束后,将反应混合液缓慢加入25mL热的饱和NaCl溶液中,并用玻璃棒搅拌,静置。待混合液充分冷却后用多层纱布进行减压过滤,分离出上层的高级脂肪酸钠。
Ⅲ.压模与成型:将分离出的高级脂肪酸钠倒入模具中冷凝固化、压模成型。
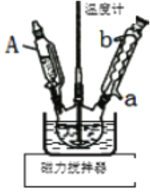
(1)仪器A为_____,冷凝管中水从_____口进(填a或b)。
(2)下列说法正确的是_____。
A.将紫草根灼烧灰化、溶解过滤、氧化、萃取也可得到香草素
B.用倾析法分离紫草根和紫草油时无需玻璃棒引流
C.用移液管量取香草油时不能伸入到容器底部
D.实验中也可用浓肥皂水代替酒精,加快皂化反应
(3)皂化刚开始时反应速率很缓慢,为加快反应速率,采取的措施有加乳化剂、____、______等方式。
(4)用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴出现,可判断皂化完全,请说明理由_____。
(5)下列关于减压过滤的说法正确的是_____。
A.减压过滤的目的主要是得到较干燥的固体
B.盐析分离所得肥皂颗粒太小,减压过滤时易透过滤纸,可用纱布代替。
C.洗涤沉淀时应先关小水龙头使洗涤剂缓慢通过沉淀物
D.在减压过滤后期,为加速过滤,可用大小合适的量筒底部对样品进行挤压。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5 mol·L-1的Na2CO3溶液1 000 mL,假如其他操作均是正确无误的,下列情况会引起配制溶液的浓度偏高的是( )
A. 称取碳酸钠晶体100 g
B. 定容时,俯视观察刻度线
C. 移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D. 定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中物质的量浓度为1mol/L的是( )
A.将40g NaOH溶解在1L水中
B.将22.4L HCl气体溶于水配成1L溶液
C.将1L 10 mol/L浓盐酸加入9L水中
D.将10g NaOH溶于少量水,在稀释到溶液为250ml
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com