
【题目】某化学兴趣小组按如下步骤制作紫草手工皂。
Ⅰ.制作紫草油:用50mL菜籽油浸泡15g紫草根30天,倾析法分离出紫草油。
Ⅱ.皂化过程:
①用移液管量取26mL紫草油、10mL95%的乙醇于三颈烧瓶中,40℃水浴加热,装置如图。
②量取20mL30%的氢氧化钠溶液,分多次缓慢加入紫草油中,边加边搅拌。
③皂化反应结束后,将反应混合液缓慢加入25mL热的饱和NaCl溶液中,并用玻璃棒搅拌,静置。待混合液充分冷却后用多层纱布进行减压过滤,分离出上层的高级脂肪酸钠。
Ⅲ.压模与成型:将分离出的高级脂肪酸钠倒入模具中冷凝固化、压模成型。
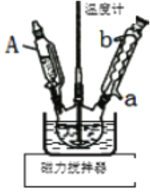
(1)仪器A为_____,冷凝管中水从_____口进(填a或b)。
(2)下列说法正确的是_____。
A.将紫草根灼烧灰化、溶解过滤、氧化、萃取也可得到香草素
B.用倾析法分离紫草根和紫草油时无需玻璃棒引流
C.用移液管量取香草油时不能伸入到容器底部
D.实验中也可用浓肥皂水代替酒精,加快皂化反应
(3)皂化刚开始时反应速率很缓慢,为加快反应速率,采取的措施有加乳化剂、____、______等方式。
(4)用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴出现,可判断皂化完全,请说明理由_____。
(5)下列关于减压过滤的说法正确的是_____。
A.减压过滤的目的主要是得到较干燥的固体
B.盐析分离所得肥皂颗粒太小,减压过滤时易透过滤纸,可用纱布代替。
C.洗涤沉淀时应先关小水龙头使洗涤剂缓慢通过沉淀物
D.在减压过滤后期,为加速过滤,可用大小合适的量筒底部对样品进行挤压。
【答案】恒压分液漏斗 a D 搅拌 加热 油脂不溶于水,硬脂酸钠为可溶性盐,若无油滴出现,可判断皂化完全 CD
【解析】
实验中,首先利用菜籽油萃取出紫草油。得到紫草油加入乙醇,得到溶液,再加入NaOH发生皂化反应,得到高级脂肪酸钠,皂化反应后,加入NaCl降低高级脂肪酸钠的溶解度,使之析出,压模成型。
(1)图中A为恒压分液漏斗;冷凝管中水下进上出冷却效果好,则冷凝管中水从a口进;
(2)A.将紫草根灼烧灰化,原来紫草根中的紫草油燃烧,变成CO2和H2O,再经过分离操作,得不到香草素;A错误;
B.过滤分离需要玻璃棒引流,防止液体流出,B错误;
C.移液管量取香草油时伸入到容器底部,便于取液体,C错误;
D.浓肥皂水代替酒精,可降低溶解度,便于分层,加快皂化反应,D正确。
答案为:D;
(3)皂化刚开始时反应速率很缓慢,为加快反应速率,采取的措施有加乳化剂、搅拌、加热等方式;
(4)用玻璃棒蘸取反应液,滴入装有热水的试管中,振荡,若无油滴出现,可判断皂化完全,理由为油脂不溶于水,硬脂酸钠为可溶性盐,若无油滴出现,可判断皂化完全;
(5)A.减压过滤的目的主要是加速过滤,同时得到较干燥的固体,A错误;
B.盐析分离所得肥皂颗粒太小,沉淀颗粒太小易在滤纸上形成一层密实的沉淀,减压过滤时,滤液不易透过滤纸,可用纱布代替,B错误;
C.洗涤沉淀时应先关小水龙头使洗涤剂缓慢通过沉淀物,便于分离,操作合理,C正确;
D.在减压过滤后期,可用大小合适的量筒底部对样品进行挤压,加速过滤,操作合理,D正确;
答案为:CD。


科目:高中化学 来源: 题型:
【题目】近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出了金刚石,具有深远的意义。下列说法错误的是( )
A.该反应是氧化还原反应B.反应中二氧化碳完全被还原为金刚石
C.钠被氧化最终生成碳酸钠D.金刚石是碳的一种同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)。
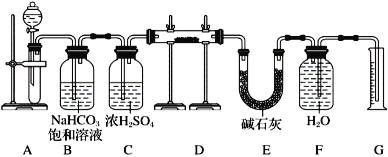
回答下列问题:
(1)连接好装置后需要进行的一步操作是:______,装置C的作用是________,装置E的作用是:____________。
(2)装置D中发生反应的化学方程式是__________、__________。
(3)若开始时测得样品的质量为2.2 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。(保留一位小数点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒,我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示:
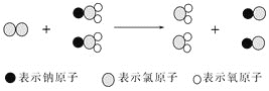
下列有关该反应的叙述正确的是( )
A.该反应是复分解反应
B.该反应的化学方程式为Cl2+2NaClO2===2ClO2+2NaCl
C.反应中Cl2既是氧化剂,又是还原剂
D.生成2 个ClO2时转移的电子数为6 个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。
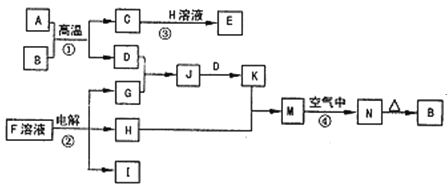
请回答下列问题:
(1)H的电子式是___,其中含有的化学键类型是___。
(2)写出反应④的现象:___,有关反应的化学方程式为___。
(3)已知I的燃烧热是-285.8kJmol-1,则1m3(标准状况)I完全燃烧,恢复至室温时放出的热量是__(计算结果保留3位有效数字)。
(4)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,则在___(填“阴”或“阳”)极附近溶液由无色变为红色,若在此极收集到0.2g气体,则此时溶液的pH是__(假设溶液的体积为2L且不考虑电解后溶液体积的变化)。
(5)在K溶液中加入与K等物质的量的Na2O2,恰好使K转化为N。写出该反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:

下列说法不正确的是
A. M的分子式为C6H12O6 B. N的结构简式为CH3COOH
C. ④的反应类型属于取代反应 D. 淀粉与纤维素互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
a | b | c | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | S | SO3 | H2SO4 |
④ | NO | NO2 | HNO3 |
⑤ | FeCl2 | Fe | FeCl3 |

A. ②⑤ B. ③④ C. ④⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸可用甲苯为原料合成,已知苯环上的硝基可被还原为氨基:![]() +3Fe+6HCl→
+3Fe+6HCl→![]() +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
A.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
B.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
C.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
D.甲苯![]() X
X![]() Y
Y![]() 对氨基苯甲酸
对氨基苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
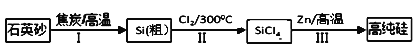
(1)1mol焦炭在过程Ⅰ中失去____mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为________。
(3)步骤(2)中的电解过程中,若用甲醇燃料电池作电源,用KOH作电解质,负极反应为_________。
(4)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_________。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是_________。
(5)Zn还原SiCl4的可逆反应如下:
SiCl4(g)+2Zn(s)![]() Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
Si(S)+2ZnCl2(g)△H<0下列说法正确的是(___)
A.还原过程需在无氧的气氛中进行 |
B.投入1molZn可生成14g还原产物 |
C.增加SiCl4(g)的量,该反应平衡常数不变 |
D.若SiCl4(g)过量可增大△H的值 |
(6)有一种由硅制作的材料中常加入Ag2SO4 ,已知某温度下Ag2SO4(M=312g/mol)的溶解度为0.624g/100g H2O,该温度下Ag2SO4的Ksp=_______(两位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com