
【题目】取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
A. 温度越高,镁与水反应的速率越快
B. 镁与水反应的化学方程式为:Mg+2H2O = Mg(OH)2+H2↑
C. 氢氧化镁显碱性,且在水中有一定的溶解性
D. 氢氧化镁是离子化合物,它的电子式可表示为:![]()
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因_______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
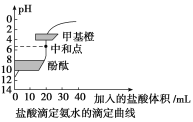
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用I2O5可使CO与H2O(g)反应转化为CO2和H2,从而有效减少大气污染。该过程可通过图1所示的两步反应循环实现。
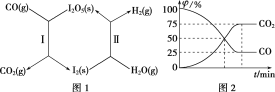
其中:反应Ⅰ为I2O5(s)+5CO(g)=I2(s)+5CO2(g) ΔH=a kJ·mol-1
反应Ⅱ中,生成1 mol H2(g)时,反应热ΔH=b kJ·mol-1。
①总反应的热化学方程式为(反应热ΔH用含a、b的代数式表示)______。
②在恒温密闭容器中加入一定量的CO(g)和I2O5(s),发生反应Ⅰ并达到平衡。测得体系中各气体组分的体积分数φ随时间t的变化如图2所示。则此反应用气体分压表示的平衡常数Kp=______(已知:气体分压=气体总压×体积分数)。
(2)已知铅盐中,Pb(NO3)2、(CH3COO)2Pb易溶于水,PbSO4、PbS难溶于水,室温下其溶度积常数为Ksp(PbSO4)=1.06×10-8;Ksp(PbS)=3.40×10-28。
①将一定量的PbSO4加入足量饱和CH3COONH4溶液中,微热,并不断搅拌,因发生复分解反应,PbSO4缓慢溶解。能发生此复分解反应的原因是______。
②某溶液中主要含有S2-、SO42-等阴离子,向其中滴加Pb(NO3)2溶液,当PbSO4开始析出时,溶液中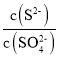 =________。
=________。
(3)钛基二氧化铅(Ti/PbO2)是重要的电极材料,工业上用电解法制作,主要流程如图:
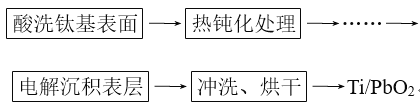
其中“电解沉积表层”是制作的关键,方法是电解可溶性铅盐溶液,使生成的PbO2沉积在阳极金属钛(Ti)上。主反应为2Pb2++2H2O=Pb+PbO2+4H+。
①必须预先将阳极金属钛进行“热钝化处理”,原因是_______。
②电解槽中,阳极主要的反应式为___;该法的缺点是阳极、阴极均会发生副反应。其中阴极上产生的气体副产物是____。
③电解法制得的PbO2晶体中含有少量的+2价铅,从而导致氧原子所在位置出现少量“空穴”(即化学式为PbOx,但x<2)。若电解时每生成1molPbOx转移1.94NA个e-(NA为阿伏加德罗常数的值),则铅元素中+2价铅所占的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素,原子序数依次递增。A元素的周期数、主族数、原子序数相同;B元素的前六级电离能的数值变化如图所示:

C元素的基态原子核外有六种不同运动状态的价电子;D与B同主族,电负性D<B;E是第四周期d区元素,血红蛋白中的E元素更易与BC形成配合物E(BC)5。
(1)写出E的基态原子电子排布式________。
(2)A3C+中,C原子采用_____杂化,离子构型为_____,比较A3C+与A2C中的键角大小并解释原因_______。
(3)D60分子中每个D原子均采用sp2杂化,则1 molD60分子中π键的数目为____。
(4)A2C有多种晶体结构,其中一种晶体中分子的空间排列方式与金刚石晶体类似,该晶体晶胞中含有____个A2C分子,A2C的配位数为_____,A2C之间的作用力为_____。已知晶胞的棱长为a pm,阿伏加德罗常数为NA,试列式计算此晶体的密度___g·cm-3(用含a、NA的代数式表示)。
(5)E(BC)5中E周围的价电子总数为____,配位原子是_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
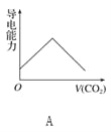
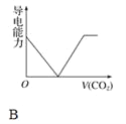

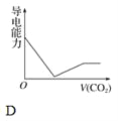
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是________。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为: NH3+ Cl2—N2+ HCl
①该反应中被氧化的元素是________(填元素名称),氧化剂是______(填化学式)。
②配平该方程式:NH3 + Cl2 — N2 + HCl __
③工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是________,产生该现象的反应方程式为________。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为________。
②反应II属于________反应。(填四种基本反应类型之一)。
③若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳”在工业生产中意义重大,充分利用原材料,不排放或减少排放“三废”,不同工厂联合生产等都是很好的“低碳”生产方式。下面是几家工厂利用废气、废液、废渣联合生产化肥硫酸铵的工艺:

请回答下列问题:
(1)操作②为______________________________________________________。
(2)工业合成氨的化学方程式为_____________________。
(3)沉淀池中生成硫酸铵的化学方程式________________________________________。
(4)在实验室中检验氨气的方法是_________________________________。
(5)副产品的化学式为________。该联合生产工艺中可以循环使用的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com