
【题目】将有机物完全燃烧,生成CO2和H2O,将12 g该有机物完全燃烧产物通过浓硫酸,浓硫酸增重14.4 g,再通过碱石灰,又增重26.4 g。则该有机物的分子式为( )
A. C4H10 B. C2H6O
C. C3H8O D. C2H4O2
【答案】C
【解析】
浓硫酸增重14.4 g,即水的质量为14.4 g,根据公式n = ![]() 计算得出水的物质的量为0.8 mol;通过碱石灰,又增重26.4 g同理计算得出二氧化碳的物质的量为0.6 mol,结合元素守恒法计算得出有机物中O元素的质量,进而可知有机物中C、H、O元素的物质的量,最后确定有机物的分子式。
计算得出水的物质的量为0.8 mol;通过碱石灰,又增重26.4 g同理计算得出二氧化碳的物质的量为0.6 mol,结合元素守恒法计算得出有机物中O元素的质量,进而可知有机物中C、H、O元素的物质的量,最后确定有机物的分子式。
浓硫酸增重可知水的质量为14.4 g,可计算出n(H2O) = ![]() = 0.8 mol,n(H) =1.6 mol,m(H) = 1.6 g;使碱石灰增重26.4 g,可知二氧化碳质量为26.4 g,n(C) = n(CO2) =
= 0.8 mol,n(H) =1.6 mol,m(H) = 1.6 g;使碱石灰增重26.4 g,可知二氧化碳质量为26.4 g,n(C) = n(CO2) = ![]() = 0.6 mol,m(C) = 7.2 g;m(C)+m(H) = 8.8 g,有机物的质量为12 g,所以有机物中氧的质量为3.2 g,n(O) =
= 0.6 mol,m(C) = 7.2 g;m(C)+m(H) = 8.8 g,有机物的质量为12 g,所以有机物中氧的质量为3.2 g,n(O) =![]() = 0.2 mol;n(C):n(H):n(O) = 0.6 mol:1.6mol:0.2mol = 3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O,故C项正确;
= 0.2 mol;n(C):n(H):n(O) = 0.6 mol:1.6mol:0.2mol = 3:8:1,即实验式为C3H8O,由于C3H8O中碳原子已经饱和,所以分子式也为C3H8O,故C项正确;
答案选C。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】有机物Ⅰ(英文名为Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药物,Esmolol的合成路线如图:

已知: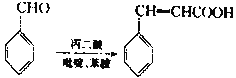
回答下列问题:
(1)C中官能团的名称有____。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H的反应类型为____;B→C反应需要的试剂和条件为____。
(4)C→D中步骤①反应的化学方程式为_____。
(5)E的结构简式为____。
(6)X是F的同分异构体,则满足下列条件的X的结构有___种。
①能发生水解反应和银镜反应;
②能与FeCl3溶液发生显色反应,且苯环上有三个取代基。
(7)参照上述合成路线,设计以 、CH3OH和
、CH3OH和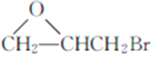 为主要原料制备
为主要原料制备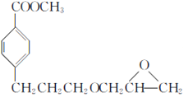 的合成路线。______
的合成路线。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
A. 温度越高,镁与水反应的速率越快
B. 镁与水反应的化学方程式为:Mg+2H2O = Mg(OH)2+H2↑
C. 氢氧化镁显碱性,且在水中有一定的溶解性
D. 氢氧化镁是离子化合物,它的电子式可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L1KI 溶液:Na+、K+、ClO 、OH
D. 常温下,![]() =10-10的溶液中:K+、Na+、I-、SO42-
=10-10的溶液中:K+、Na+、I-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )

A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
zC(g),图①表示200 ℃时容器中A、B、C的物质的量随时间的变化,图②表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是 ( )
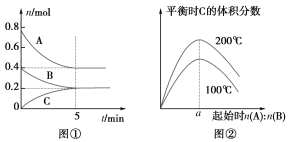
A. 200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 由图②知反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C. 若在图①所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D. 200 ℃,6 min时向容器中充入2 mol A和1 mol B,重新达到平衡时,A的体积分数大于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是( )
A. 在K37ClO3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若有212克氯气生成,则反应中电子转移的数目为5NA
B. 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液,碳酸钠溶液中红色更深,证明阴离子水解常数Kh: CO32->HCO3-
C. 含0.2molH2SO4的浓硫酸与足量Zn完全反应,转移的电子数目可能为0.3NA
D. 标准状况下,33.6L Cl2与足量CH4在光照条件下充分反应,生成的C-Cl键数目为3.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是( )
A. 选择合适的试剂,用图1装置可分别制取和收集少量CO2、NO 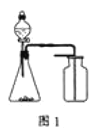
B. 除去石英(主要成分SiO2)中少量碳酸钙:用稀盐酸溶解后过滤
C. 洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干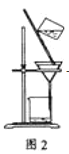
D. 用广泛pH试纸测得0.1molL-1NH4Cl溶液的pH=5.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com